GIÁO ÁN MÔN HÓA 10 - BÀI 14. TÍNH BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG HOÁ HỌC được soạn dưới dạng file word/PDF/ powerpoint gồm 20 trang. Các bạn xem và tải về ở dưới.
Ví dụ 3: Tính biến thiên enthalpy chuẩn của phản ứng
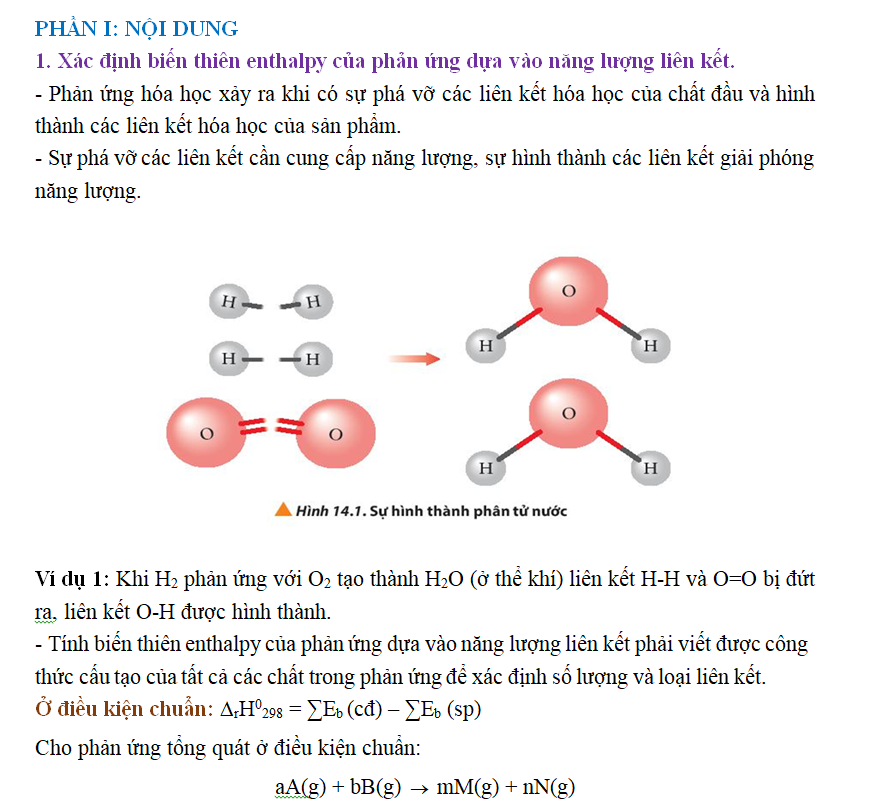
Bước 1: Tính năng lượng cần thiết để phá vỡ 1 mol H – H và 1 mol Cl – Cl
Tổng năng lượng thu vào để phá vỡ các liên kết: Eb (H – H) + Eb (Cl – Cl) = 432 + 243 = 675 kJ
Bước 2: Tính năng lượng toả ra khi hình thành 2 mol H – Cl
Tổng năng lượng toả ra để hình thành liên kết: 2 × Eb (H – Cl) = 2 × 427 = 854 kJ
Bước 3: Tính biến thiên enthalpy của phản ứng theo công thức (1) ∆rH0298 = 675 – 854 = –179 kJ. Do ∆rH0298 < 0 nên phản ứng toả nhiệt.
Ví dụ 4: Xác định biến thiên enthalpy chuẩn của phản ứng.
biết Eb (H—H) = 436 kJ/mol Eb (C—H) = 418 kJ/mol
Eb (C—C) = 346 kJ/mol Eb (C=C) = 612 kJ/mol.
Biến thiên enthalpy chuẩn của phản ứng là:
∆rH0298 = Eb (C=C) + 4Eb (C—H) + Eb (H—H) - Eb (C—C) - 6Eb (C—H)
= 612 + 4.418 + 436 – 346 – 6.418 = -134 kJ
Ví dụ 5: Tính biến thiên enthanpy của phản ứng tạo thành ammonia (sử dụng năng lượng liên kết). Cho biết phản ứng thu nhiệt hay toả nhiệt và vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
Ví dụ 3: Tính biến thiên enthalpy chuẩn của phản ứng
H2(g) + Cl2(g) 2HCl(g)
Hướng dẫn giải
Hướng dẫn giải
Bước 1: Tính năng lượng cần thiết để phá vỡ 1 mol H – H và 1 mol Cl – Cl
Tổng năng lượng thu vào để phá vỡ các liên kết: Eb (H – H) + Eb (Cl – Cl) = 432 + 243 = 675 kJ
Bước 2: Tính năng lượng toả ra khi hình thành 2 mol H – Cl
Tổng năng lượng toả ra để hình thành liên kết: 2 × Eb (H – Cl) = 2 × 427 = 854 kJ
Bước 3: Tính biến thiên enthalpy của phản ứng theo công thức (1) ∆rH0298 = 675 – 854 = –179 kJ. Do ∆rH0298 < 0 nên phản ứng toả nhiệt.
Ví dụ 4: Xác định biến thiên enthalpy chuẩn của phản ứng.
C2H4(g) + H2(g) C2H6(g)
biết Eb (H—H) = 436 kJ/mol Eb (C—H) = 418 kJ/mol
Eb (C—C) = 346 kJ/mol Eb (C=C) = 612 kJ/mol.
Hướng dẫn giải
Biến thiên enthalpy chuẩn của phản ứng là:
∆rH0298 = Eb (C=C) + 4Eb (C—H) + Eb (H—H) - Eb (C—C) - 6Eb (C—H)
= 612 + 4.418 + 436 – 346 – 6.418 = -134 kJ
Ví dụ 5: Tính biến thiên enthanpy của phản ứng tạo thành ammonia (sử dụng năng lượng liên kết). Cho biết phản ứng thu nhiệt hay toả nhiệt và vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
TỆP ĐÍNH KÈM
Tệp đính kèm đã được mở. Bạn có thể tải tài nguyên dưới đây.
CÁC TỆP ĐÍNH KÈM (2)
- YOPO.VN---GA HOA 10. Bài 14 - Tình biến thiên Enthapy của phản ứng hóa học (Đã sửa)..docxDung lượng tệp: 393.1 KB
BẠN MUỐN MUA TÀI NGUYÊN NÀY?
Các tệp đính kèm trong chủ đề này cần được thanh toán để tải. Chi phí tải các tệp đính kèm này là 0 VND. Dành cho khách không muốn tham gia gói THÀNH VIÊN VIP
GIÁ TỐT HƠN
Gói thành viên VIP
- Tải được file ở nhiều bài
- Truy cập được nhiều nội dung độc quyền
- Không quảng cáo, không bị làm phiền
- Tải tài nguyên đề thi, giáo án... từ khối 1-12
- Tải mở rộng sáng kiến, chuyên đề, báo cáo...
- Được tư vấn, hỗ trợ qua zalo 0979.702.422
🔥 Chỉ từ
200K
Mua gói lẻ
- Chỉ tải duy nhất toàn bộ file trong bài đã mua
- Cần mua file ở bài khác nếu có nhu cầu tải
- Tốn kém cho những lần mua tiếp theo
- Được tư vấn, hỗ trợ qua zalo 0979.702.422
0 VND
Sau khi thanh toán thành công, hệ thống sẽ tự động chuyển hướng bạn về trang download tài liệu


 HƯỚNG DẪN ĐĂNG KÝ THÀNH VIÊN THƯỜNG
HƯỚNG DẪN ĐĂNG KÝ THÀNH VIÊN THƯỜNG