Bộ Đề thi hóa giữa học kì 2 lớp 10 CÓ ĐÁP ÁN TRẮC NGHIỆM NĂM 2022
YOPOVN xin gửi đến quý thầy cô, các em học sinh Bộ Đề thi hóa giữa học kì 2 lớp 10 CÓ ĐÁP ÁN TRẮC NGHIỆM NĂM 2022. Đây là bộ đề thi hóa giữa học kì 2 lớp 10, đề thi hóa học kì 2 lớp 10 trắc nghiệm, đề thi hóa giữa học kì 2 lớp 10, đề thi thử môn hóa lớp 10 học kì 2, đề thi học kì 2 môn hóa lớp 10 violet, một số đề thi hóa học kì 2 lớp 10... chọn lọc soạn theo file word. Thầy cô download Bộ Đề thi hóa giữa học kì 2 lớp 10 CÓ ĐÁP ÁN TRẮC NGHIỆM NĂM 2022 tại mục đính kèm.
I. PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1: Axit clohiđric khi tiếp xúc với quỳ tím làm quỳ tím
A. chuyển sang màu vàng. B. chuyển sang màu đỏ.
C. chuyển sang màu xanh. D. không chuyển màu.
Câu 2: Axit nào sau đây có trong dịch vị dạ dày, giúp tiêu hóa thức ăn?
A. HI. B. HF. C. HCl. D. HBr.
Câu 3: Kim loại nào sau đây tác dụng với dung dịch axit clohiđric?
A. Cu. B. Au. C. Fe. D. Ag.
Câu 4: Số electron lớp ngoài cùng của các nguyên tố nhóm oxi là
A. 8. B. 4. C. 6. D. 2.
Câu 5: Người ta điều chế oxi trong công nghiệp bằng cách nào sau đây?
A. Nhiệt phân KClO3 với xúc tác MnO2. B. Nhiệt phân KMnO4.
C. Điện phân dung dịch NaOH. D. Chưng cất phân đoạn không khí lỏng.
Câu 6: Để phân biệt khí O2 và O3 có thể dùng kim loại
A. Ag. B. Fe. C. Cu. D. Al.
Câu 7: Nước Gia-ven có ứng dụng nào sau đây?
A. Dung môi hòa tan các chất. B. Sản xuất chất dẻo.
C. Giải khát. D. Tẩy trắng sợi, vải.
Câu 8: Axit clohiđric thể hiện tính khử trong phản ứng nào sau đây?
A. 2HCl + CuO CuCl2 + H2O.
B. 4HCl + MnO2 MnCl2 + Cl2 + 2H2O.
C. 2HCl + K2CO3 2KCl + CO2 + H2O.
D. 2HCl + Mg(OH)2 MgCl2 + 2H2O.
Câu 9: Trong hợp chất clorua vôi có
A. nhóm hiđroxit. B. một loại gốc axit.
C. hai loại gốc axit. D. ba loại gốc axit.
Câu 10: Các ứng dụng của clorua vôi dựa trên cơ sở
A. tính khử mạnh. B. tính oxi hoá mạnh.
C. tính tẩy trắng. D. tính sát trùng.
Câu 11: Clo không phản ứng với chất nào sau đây?
A. NaI. B. H2O. C. NaOH. D. HCl.
Câu 12: Phát biểu nào sau đây về oxi đúng?
A. Tan rất ít trong nước. B. Chất khí không màu, mùi xốc.
C. Chất khí nhẹ hơn không khí. D. Dưới áp suất khí quyển, hóa lỏng ở -1190C.
Câu 13: Phát biểu nào sau đây đúng khi nói về oxi và ozon?
A. Đều có số proton giống nhau trong phân tử.
B. Là các dạng thù hình của cùng một nguyên tố halogen.
C. Ozon có tính oxi hóa mạnh hơn oxi.
D. Đều phản ứng được với Ag ở nhiệt độ thường.
Câu 14: Tính chất sát trùng và tẩy màu của nước Gia-ven là do nguyên nhân nào sau đây?
A. Do trong phân tử NaCl, nguyên tử Cl với số oxi hoá -1, thể hiện tính oxi hoá mạnh.
B. Do chất NaClO phân huỷ ra oxi nguyên tử có tính oxi hoá mạnh.
C. Do chất NaClO phân huỷ ra Cl2 là chất oxi hoá mạnh.
D. Do trong phân tử NaClO, nguyên tử Cl có số oxi hoá +1, thể hiện tính oxi hoá mạnh.
Câu 15: Khi cho dung dịch AgNO3 vào dung dịch NaCl thu được kết tủa có màu
A. vàng. B. đỏ. C. xanh. D. trắng.
Câu 16: Trong phòng thí nghiệm, để điều chế clo, người ta dùng KMnO4 với vai trò là
A. chất oxi hóa. B. chất xúc tác.
C. chất khử. D. vừa là chất oxi hoá, vừa là chất khử.
Câu 17: Hòa tan hoàn toàn 33,6 gam bột Fe vào dung dịch HCl dư, thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 2,24. B. 13,44. C. 8,96. D. 4,48.
Câu 18: Để thu được 3,36 lít O2 (đktc), cần nhiệt phân hoàn toàn a mol tinh thể KClO3. Giá trị của a là
A. 0,10. B. 0,15. C. 0,30. D. 0,20.
Câu 19: Dãy nào sau đây sắp xếp đúng theo thứ tự giảm dần tính axit của các dung dịch?
A. HCl > HBr > HF > HI. B. HI > HBr > HCl > HF.
C. HF > HCl > HBr > HI. D. HCl > HBr > HI > HF.
Câu 20: Cấu hình electron nguyên tử chung ở lớp ngoài cùng của các nguyên tử halogen là
A. ns2np4. B. 3s23p5. C. ns2np5. D. 2s22p5.
Câu 21: Phát biểu nào sau đây sai?
A. Khả năng oxi hóa của halogen tăng dần từ flo đến iot.
B. Các halogen có tính chất hóa học gần giống nhau.
C. Halogen là những chất oxi hóa mạnh.
D. Trong hợp chất, flo không có số oxi hóa dương.
Câu 22: Trong phòng thí nghiệm, khí clo có thể được điều chế bằng cách cho axit clohiđric đặc tác dụng với chất rắn nào sau đây?
A. MnCl2. B. CaCl2. C. KMnO4. D. NaCl.
Câu 23: Khí clo có màu
A. nâu đỏ. B. lục nhạt. C. tím đen. D. vàng lục.
Câu 24: Ở điều kiện thường, halogen nào sau đây là chất rắn?
A. Iot. B. Brom. C. Clo. D. Flo.
Câu 25: Ứng dụng nào sau đây không phải của clo?
A. Sản xuất clorua vôi, kali clorat. B. Khử trùng nước sinh hoạt.
C. Tinh chế dầu mỏ. D. Tẩy trắng vải, sợi, giấy.
Câu 26: Halogen có trong hợp chất tạo nên men răng của người và động vật là
A. flo. B. iot. C. brom. D. clo.
Câu 27: Trong phản ứng: 3Cl2 + 2Fe 2FeCl3, clo đóng vai trò
A. chất tan. B. chất khử.
C. vừa là chất oxi hóa, vừa là chất khử. D. chất oxi hóa.
Câu 28: Thể tích (lít) khí clo cần dùng để phản ứng vừa đủ với dung dịch chứa 0,075 mol NaI là
A. 8,40. B. 1,68. C. 0,42. D. 0,84.
II. PHẦN TỰ LUẬN (3,0 điểm)
Câu 1 (1,0 điểm): Viết phương trình hóa học xảy ra (nếu có) giữa các cặp chất sau. Nếu không xảy ra phản ứng thì đánh dấu chéo lên dấu mũi tên.
a. Cu + Cl2 b. KBr + Cl2
Câu 2 (1,0 điểm): Cho 22,5 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 (đktc) và m gam chất rắn không tan. Tính m.
Câu 3 (0,5 điểm): Dung dịch cloramin-B có tác dụng diệt khuẩn mạnh, được sử dụng phổ biến để diệt khuẩn bề mặt ở các khu vực cách ly bệnh nhân và người nghi nhiễm vi rút SARS-CoV-2. Clo cũng là một tác nhân có tính diệt khuẩn mạnh. Có nên dùng clo để thay thế cho dung dịch cloramin-B không? Vì sao?
Câu 4 (0,5 điểm): Hỗn hợp khí X gồm ozon và oxi có tỉ khối đối với hiđro bằng 17,2. Tính phần trăm theo thể tích mỗi khí trong hỗn hợp X.
I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (7,0 đ):
II. PHẦN TRẮC NGHIỆM TỰ LUẬN (3,0 đ):
I. PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1: Khí flo có màu
A. tím đen. B. vàng lục. C. nâu đỏ. D. lục nhạt.
Câu 2: Khi nung nóng, iot rắn chuyển ngay thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. sự ngưng tụ. B. sự thăng hoa. C. sự bay hơi. D. sự phân hủy.
Câu 3: Liên kết giữa nguyên tử hiđro và clo trong phân tử HCl là liên kết
A. cộng hóa trị không cực. B. ion.
C. đôi. D. cộng hóa trị phân cực.
Câu 4: Phát biểu nào sau đây về hiđro clorua là đúng?
A. Ít tan trong nước. B. Có tính axit.
C. Là chất khí ở điều kiện thường. D. Không mùi.
Câu 5: Kim loại nào sau đây không tác dụng với dung dịch axit clohiđric?
A. Fe. B. Al. C. Cu. D. Zn.
Câu 6: Khí G thường được dùng để khử trùng nước sinh hoạt. Khí G là
A. CO2. B. F2. C. O2. D. Cl2.
Câu 7: Clo không phản ứng với chất nào sau đây?
A. NaBr. B. NaOH. C. KCl. D. Ca(OH)2.
Câu 8: Trong phản ứng: Cl2 + H2 2HCl, clo đóng vai trò
A. chất oxi hóa. B. chất tan.
C. chất khử. D. vừa là chất oxi hóa, vừa là chất khử.
Câu 9: Clorua vôi có công thức hóa học là
A. CaOCl2. B. CaCl2. C. CaOCl. D. Ca(OCl)2.
Câu 10: Nước Gia-ven không có ứng dụng nào sau đây?
A. Tẩy uế khu vực bị ô nhiễm. B. Sản xuất chất dẻo. C. Tẩy trắng sợi, vải. D. Sát trùng nhà vệ sinh.
Câu 11: Nước Gia-ven có tính tẩy màu và sát trùng do
A. NaCl có tính khử mạnh. B. NaClO có tính oxi hóa mạnh. C. NaClO có tính khử mạnh. D. NaCl có tính oxi hóa mạnh.
Câu 12: Nhận biết gốc clorua trong dung dịch người ta thường dùng dung dịch
A. Na2SO4. B. Cu(NO3)2. C. Ba(NO3)2. D. AgNO3.
Câu 13: Phát biểu nào sau đây về oxi đúng?
A. Chất khí không màu, không mùi, không vị.
B. Tan nhiều trong nước.
C. Chất khí nhẹ hơn không khí.
D. Dưới áp suất khí quyển, hóa lỏng ở -1120C.
Câu 14: Người ta điều chế oxi trong phòng thí nghiệm bằng cách nào sau đây?
A. Điện phân dung dịch NaOH. B. Nhiệt phân KClO3 với xúc tác MnO2.
C. Chưng cất phân đoạn không khí lỏng. D. Điện phân nước.
Câu 15: Phản ứng tạo ozon từ oxi cần điều kiện
A. nhiệt độ cao. B. áp suất cao.
C. tia lửa điện hoặc tia cực tím. D. xúc tác bột Fe.
Câu 16: Để thu được 6,72 lít O2 (đktc), cần nhiệt phân hoàn toàn a mol tinh thể KClO3. Giá trị của a là
A. 0,10. B. 0,20. C. 0,30. D. 0,15.
Câu 17: Trái cây được bảo quản lâu hơn trong môi trường vô trùng. Trong thực tế, người ta sử dụng nước ozon để bảo quản trái cây. Ứng dụng trên dựa vào tính chất nào sau đây của ozon?
A. Không tác dụng được với nước. B. Trơ về mặt hoá học.
C. Chất khí có mùi đặc trưng. D. Có tính oxi hoá mạnh.
Câu 18: Trong phòng thí nghiệm, để điều chế clo, người ta dùng MnO2 với vai trò là
A. vừa là chất oxi hoá, vừa là chất khử. B. chất xúc tác.
C. chất oxi hoá. D. chất khử.
Câu 19: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm oxi là
A. ns2np6. B. ns2np4. C. ns2np5. D. ns2np3.
Câu 20: Trong bảng hệ thống tuần hoàn, các nguyên tố halogen thuộc nhóm
A. VA. B. VIIA. C. VIA. D. VIIIA.
Câu 21: Ở điều kiện thường, halogen nào sau đây là chất lỏng?
A. Iot. B. Brom. C. Clo. D. Flo.
Câu 22: Phát biểu nào sau đây sai?
A. Halogen là những chất oxi hóa mạnh.
B. Các halogen có tính chất hóa học gần giống nhau.
C. Trong hợp chất, các halogen đều có thể có số oxi hóa: -1; +1; +3; +5; +7.
D. Khả năng oxi hóa của halogen giảm dần từ flo đến iot.
Câu 23: Hòa tan hoàn toàn 22,4 gam bột Fe vào dung dịch HCl dư, thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 2,24. B. 4,48. C. 8,96. D. 17,92.
Câu 24: Trong công nghiệp, khí clo được điều chế từ
A. MnO2. B. HCl. C. NaCl. D. KMnO4.
Câu 25: Thể tích (lít) khí clo cần dùng để phản ứng vừa đủ với dung dịch chứa 0,03 mol NaI là
A. 0,336. B. 3,360. C. 0,672. D. 0,168.
Câu 26: Axit clohiđric thể hiện tính khử trong phản ứng nào sau đây?
A. 2HCl + Na2CO3 2NaCl + CO2 + H2O.
B. 4HCl + MnO2 MnCl2 + Cl2 + 2H2O.
C. 2HCl + MgO MgCl2 + H2O.
D. 2HCl + Ba(OH)2 MgCl2 + 2H2O.
Câu 27: Dãy nào sau đây sắp xếp đúng theo thứ tự tăng dần tính axit của các dung dịch?
A. HCl < HBr < HF < HI. B. HI < HBr < HCl < HF.
C. HF < HCl < HBr < HI. D. HCl < HBr < HI < HF.
Câu 28: Tính chất sát trùng và tẩy màu của clorua vôi là do nguyên nhân nào sau đây?
A. Do trong phân tử có nguyên tử Cl với số oxi hoá +1, thể hiện tính oxi hoá mạnh.
B. Do trong phân tử, gốc ClO- phân huỷ ra oxi nguyên tử có tính oxi hoá mạnh.
C. Do trong phân tử, gốc ClO- phân huỷ ra Cl2 là chất oxi hoá mạnh.
D. Do trong phân tử có nguyên tử Cl với số oxi hoá -1, thể hiện tính oxi hoá mạnh.
II. PHẦN TỰ LUẬN (3,0 điểm)
Câu 1 (1,0 điểm): Viết phương trình hóa học xảy ra (nếu có) giữa các cặp chất sau. Nếu không xảy ra phản ứng thì đánh dấu chéo lên dấu mũi tên.
a. Na + Cl2 b. KI + Br2
Câu 2 (1,0 điểm): Cho 30,0 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Tính m.
Câu 3 (0,5 điểm): Dung dịch muối ăn có khả năng diệt khuẩn, được dùng để súc họng, ngâm rửa rau quả, ... Một học sinh đề xuất sử dụng dung dịch muối ăn để sát khuẩn tay, ngăn chặn sự phát tán của vi rút SARS-CoV-2 thay cho dung dịch rửa tay khô. Đề xuất đó có hợp lý hay không? Vì sao?
Câu 4 (0,5 điểm): Hỗn hợp khí X gồm ozon và oxi có tỉ khối đối với hiđro bằng 17,6. Tính phần trăm theo thể tích mỗi khí trong hỗn hợp X.
I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (7,0 đ):
II. PHẦN TRẮC NGHIỆM TỰ LUẬN (3,0 đ):
A. PHẦN TRẮC NGHIỆM: (4 điểm)
Câu 1: Thuốc thử dùng để phân biệt hai dung dịch NaI và NaCl là
A. Hồ tinh bột. B. Dung dịch AgNO3.
C. Dung dịch nước vôi trong. D. Quỳ tím.
Câu 2: Cho các dung dịch axit: HCl, HF, HBr, HI. Dung dịch có tính axit mạnh nhất là
A. HCl. B. HF. C. HBr. D. HI.
Câu 3: Trong phản ứng MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O, vai trò của MnO2 là chất
A. môi trường. B. khử. C. bị khử. D. bị oxi hóa.
Câu 4: Hòa tan hoàn toàn 3,6 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 duy nhất (đktc). Giá trị của V là
A. 0,448 lít. B. 4,48 lít. C. 6,72lít. D. 0,672 lít.
Câu 5: Cho khí clo tác dụng với dung dịch X ở nhiệt độ thường thu được Clorua vôi. Dung dịch X là
A. dd KI. B. dd AgNO3. C. dd NaOH. D. dd Ca(OH)2.
Câu 6: Cho 6,72 lít khí clo (đktc) tác dụng hết với m gam nhôm. Giá trị của m là
A. 5,4 gam. B. 2,7 gam. C. 4,05 gam. D. 8,1 gam.
Câu 7: Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu.
(c) Dung dịch NaF loãng được dùng làm thuốc ngừa sâu răng.
(d) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5, +7
Trong số các phát biểu trên, số phát biểu sai là
A. 4 B. 1 C. 2 D. 3
Câu 8: Số oxi hóa của Clo trong các hợp chất HCl, HClO, KClO3, HClO2 lần lượt là
A. -1, +1, +5, -1. B. -1, +1, +3, -1. C. -1, +1, +5, +3. D. +1, +1, +5, +3.
Câu 9: Cho các phát biểu sau:
(1) Các halogen là những phi kim mạnh nhất trong mỗi chu kỳ.
(2) Các halogen đều tác dụng trực tiếp với oxi.
(3) Các halogen đều có 7 electron lớp ngoài cùng thuộc phân lớp s và p.
(4) Tính oxi hoá của các halogen tăng dần từ flo đến iot.
Số phát biểu sai là
A. 4. B. 1. C. 3. D. 2.
Câu 10: Cho các phản ứng sau
4HCl + PbO2 PbCl2 + Cl2 + 2H2O.
HCl + NH4HCO3 NH4Cl + CO2 + H2O.
2HCl + 2HNO3 2NO2 + Cl2 + 2H2O.
2HCl + Zn ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2. B. 4. C. 3. D. 1.
Câu 11: Cho phản ứng sau: NaXrắn + H2SO4 đặc NaHSO4 + HX khí
Các hiđro halogennua (HX) có thể điều chế theo phản ứng trên là
A. HF, HCl, HBr, HI. B. HCl, HBr, HI. C. HF, HCl. D. HBr, HI.
Câu 12: Halogen X ở điều kiện thường là chất rắn, màu đen tím. X là
A. Cl2. B. I2. C. Br2. D. F2.
Câu 13: Cho hình vẽ mô tả thí nghiệm điều chế clo trong phòng thí nghiệm như sau:
Bình (1) đựng NaCl, bình (2) đựng dung dịch H2SO4 đặc. Vai trò của bình (1) là
A. Giữ lại khí HCl. B. Giữ lại hơi nước.
C. Hòa tan khí Cl2. D. Làm sạch bụi.
Câu 14: Quá trình khử là quá trình
A. nhường proton. B. nhận proton.
C. thu electron. D. nhường electron.
Câu 15: Thể tích khí clo (đktc) thu được khi cho KMnO4 tác dụng hết với dung dịch chứa 0,8 mol HCl (giả thiết hiệu suất đạt 100%) là
A. 4,48 lít. B. 5,6 lít. C. 1,12 lít. D. 8,96 lít.
Câu 16: Cho các kim loại: Na, Zn, Fe, Cu, Ag. Số kim loại phản ứng được với dung dịch HCl là
A. 3. B. 1. C. 4. D. 2.
B. PHẦN TỰ LUẬN: (6 điểm)
Câu 1: (1,0đ) Lập phương trình hóa học của phản ứng sau theo phương pháp thăng bằng electron:
Câu 2: (2,0đ) Viết phương trình hóa học xảy ra (ghi rõ điều kiện phản ứng nếu có) khi cho:
a) Cl2 + H2O b) O2 + I2
c) Ca + F2 d) MgBr2 + AgNO3
Câu 3: (2,0đ) Hòa tan 20 gam hỗn hợp gồm hai kim loại Cu và Al bằng lượng dư dung dịch HCl, sau khi phản ứng hoàn toàn V lít khí H2 (đktc) và còn 3,8 gam kim loại không tan.
a) Tìm % khối lượng mỗi kim loại trong hỗn hợp đầu.
b) Tìm giá trị của V.
Câu 4: (1,0đ) Cho 8,96 lít khí Cl2 (đktc) vào 200 gam dung dịch NaOH 20% ở nhiệt độ thường thu được dung dịch X. Tính khối lượng các chất tan trong dung dịch X.
Lưu ý: 1) Học sinh không được sử dụng Bảng tuần hoàn.
2) Cán bộ coi kiểm tra không được giải thích gì thêm.
XEM THÊM
Phần đáp án câu trắc nghiệm: 4 điểm
II. Tự luận: 6 điểm
YOPOVN xin gửi đến quý thầy cô, các em học sinh Bộ Đề thi hóa giữa học kì 2 lớp 10 CÓ ĐÁP ÁN TRẮC NGHIỆM NĂM 2022. Đây là bộ đề thi hóa giữa học kì 2 lớp 10, đề thi hóa học kì 2 lớp 10 trắc nghiệm, đề thi hóa giữa học kì 2 lớp 10, đề thi thử môn hóa lớp 10 học kì 2, đề thi học kì 2 môn hóa lớp 10 violet, một số đề thi hóa học kì 2 lớp 10... chọn lọc soạn theo file word. Thầy cô download Bộ Đề thi hóa giữa học kì 2 lớp 10 CÓ ĐÁP ÁN TRẮC NGHIỆM NĂM 2022 tại mục đính kèm.
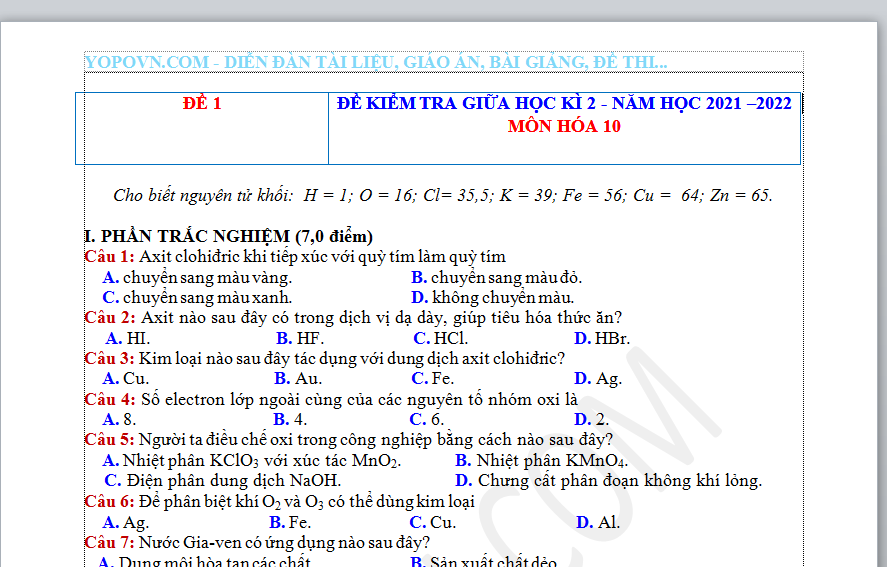
ĐỀ 1 | ĐỀ KIỂM TRA GIỮA HỌC KÌ 2 - NĂM HỌC 2021 –2022 MÔN HÓA 10 |
Cho biết nguyên tử khối: H = 1; O = 16; Cl= 35,5; K = 39; Fe = 56; Cu = 64; Zn = 65.
I. PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1: Axit clohiđric khi tiếp xúc với quỳ tím làm quỳ tím
A. chuyển sang màu vàng. B. chuyển sang màu đỏ.
C. chuyển sang màu xanh. D. không chuyển màu.
Câu 2: Axit nào sau đây có trong dịch vị dạ dày, giúp tiêu hóa thức ăn?
A. HI. B. HF. C. HCl. D. HBr.
Câu 3: Kim loại nào sau đây tác dụng với dung dịch axit clohiđric?
A. Cu. B. Au. C. Fe. D. Ag.
Câu 4: Số electron lớp ngoài cùng của các nguyên tố nhóm oxi là
A. 8. B. 4. C. 6. D. 2.
Câu 5: Người ta điều chế oxi trong công nghiệp bằng cách nào sau đây?
A. Nhiệt phân KClO3 với xúc tác MnO2. B. Nhiệt phân KMnO4.
C. Điện phân dung dịch NaOH. D. Chưng cất phân đoạn không khí lỏng.
Câu 6: Để phân biệt khí O2 và O3 có thể dùng kim loại
A. Ag. B. Fe. C. Cu. D. Al.
Câu 7: Nước Gia-ven có ứng dụng nào sau đây?
A. Dung môi hòa tan các chất. B. Sản xuất chất dẻo.
C. Giải khát. D. Tẩy trắng sợi, vải.
Câu 8: Axit clohiđric thể hiện tính khử trong phản ứng nào sau đây?
A. 2HCl + CuO CuCl2 + H2O.
B. 4HCl + MnO2 MnCl2 + Cl2 + 2H2O.
C. 2HCl + K2CO3 2KCl + CO2 + H2O.
D. 2HCl + Mg(OH)2 MgCl2 + 2H2O.
Câu 9: Trong hợp chất clorua vôi có
A. nhóm hiđroxit. B. một loại gốc axit.
C. hai loại gốc axit. D. ba loại gốc axit.
Câu 10: Các ứng dụng của clorua vôi dựa trên cơ sở
A. tính khử mạnh. B. tính oxi hoá mạnh.
C. tính tẩy trắng. D. tính sát trùng.
Câu 11: Clo không phản ứng với chất nào sau đây?
A. NaI. B. H2O. C. NaOH. D. HCl.
Câu 12: Phát biểu nào sau đây về oxi đúng?
A. Tan rất ít trong nước. B. Chất khí không màu, mùi xốc.
C. Chất khí nhẹ hơn không khí. D. Dưới áp suất khí quyển, hóa lỏng ở -1190C.
Câu 13: Phát biểu nào sau đây đúng khi nói về oxi và ozon?
A. Đều có số proton giống nhau trong phân tử.
B. Là các dạng thù hình của cùng một nguyên tố halogen.
C. Ozon có tính oxi hóa mạnh hơn oxi.
D. Đều phản ứng được với Ag ở nhiệt độ thường.
Câu 14: Tính chất sát trùng và tẩy màu của nước Gia-ven là do nguyên nhân nào sau đây?
A. Do trong phân tử NaCl, nguyên tử Cl với số oxi hoá -1, thể hiện tính oxi hoá mạnh.
B. Do chất NaClO phân huỷ ra oxi nguyên tử có tính oxi hoá mạnh.
C. Do chất NaClO phân huỷ ra Cl2 là chất oxi hoá mạnh.
D. Do trong phân tử NaClO, nguyên tử Cl có số oxi hoá +1, thể hiện tính oxi hoá mạnh.
Câu 15: Khi cho dung dịch AgNO3 vào dung dịch NaCl thu được kết tủa có màu
A. vàng. B. đỏ. C. xanh. D. trắng.
Câu 16: Trong phòng thí nghiệm, để điều chế clo, người ta dùng KMnO4 với vai trò là
A. chất oxi hóa. B. chất xúc tác.
C. chất khử. D. vừa là chất oxi hoá, vừa là chất khử.
Câu 17: Hòa tan hoàn toàn 33,6 gam bột Fe vào dung dịch HCl dư, thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 2,24. B. 13,44. C. 8,96. D. 4,48.
Câu 18: Để thu được 3,36 lít O2 (đktc), cần nhiệt phân hoàn toàn a mol tinh thể KClO3. Giá trị của a là
A. 0,10. B. 0,15. C. 0,30. D. 0,20.
Câu 19: Dãy nào sau đây sắp xếp đúng theo thứ tự giảm dần tính axit của các dung dịch?
A. HCl > HBr > HF > HI. B. HI > HBr > HCl > HF.
C. HF > HCl > HBr > HI. D. HCl > HBr > HI > HF.
Câu 20: Cấu hình electron nguyên tử chung ở lớp ngoài cùng của các nguyên tử halogen là
A. ns2np4. B. 3s23p5. C. ns2np5. D. 2s22p5.
Câu 21: Phát biểu nào sau đây sai?
A. Khả năng oxi hóa của halogen tăng dần từ flo đến iot.
B. Các halogen có tính chất hóa học gần giống nhau.
C. Halogen là những chất oxi hóa mạnh.
D. Trong hợp chất, flo không có số oxi hóa dương.
Câu 22: Trong phòng thí nghiệm, khí clo có thể được điều chế bằng cách cho axit clohiđric đặc tác dụng với chất rắn nào sau đây?
A. MnCl2. B. CaCl2. C. KMnO4. D. NaCl.
Câu 23: Khí clo có màu
A. nâu đỏ. B. lục nhạt. C. tím đen. D. vàng lục.
Câu 24: Ở điều kiện thường, halogen nào sau đây là chất rắn?
A. Iot. B. Brom. C. Clo. D. Flo.
Câu 25: Ứng dụng nào sau đây không phải của clo?
A. Sản xuất clorua vôi, kali clorat. B. Khử trùng nước sinh hoạt.
C. Tinh chế dầu mỏ. D. Tẩy trắng vải, sợi, giấy.
Câu 26: Halogen có trong hợp chất tạo nên men răng của người và động vật là
A. flo. B. iot. C. brom. D. clo.
Câu 27: Trong phản ứng: 3Cl2 + 2Fe 2FeCl3, clo đóng vai trò
A. chất tan. B. chất khử.
C. vừa là chất oxi hóa, vừa là chất khử. D. chất oxi hóa.
Câu 28: Thể tích (lít) khí clo cần dùng để phản ứng vừa đủ với dung dịch chứa 0,075 mol NaI là
A. 8,40. B. 1,68. C. 0,42. D. 0,84.
II. PHẦN TỰ LUẬN (3,0 điểm)
Câu 1 (1,0 điểm): Viết phương trình hóa học xảy ra (nếu có) giữa các cặp chất sau. Nếu không xảy ra phản ứng thì đánh dấu chéo lên dấu mũi tên.
a. Cu + Cl2 b. KBr + Cl2
Câu 2 (1,0 điểm): Cho 22,5 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 (đktc) và m gam chất rắn không tan. Tính m.
Câu 3 (0,5 điểm): Dung dịch cloramin-B có tác dụng diệt khuẩn mạnh, được sử dụng phổ biến để diệt khuẩn bề mặt ở các khu vực cách ly bệnh nhân và người nghi nhiễm vi rút SARS-CoV-2. Clo cũng là một tác nhân có tính diệt khuẩn mạnh. Có nên dùng clo để thay thế cho dung dịch cloramin-B không? Vì sao?
Câu 4 (0,5 điểm): Hỗn hợp khí X gồm ozon và oxi có tỉ khối đối với hiđro bằng 17,2. Tính phần trăm theo thể tích mỗi khí trong hỗn hợp X.
----- Hết -----
Học sinh được sử dụng bảng Hệ thống tuần hoàn các nguyên tố hóa học.
ĐÁP ÁN
Học sinh được sử dụng bảng Hệ thống tuần hoàn các nguyên tố hóa học.
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (7,0 đ):
1 | B | 6 | A | 11 | D | 16 | A | 21 | A | 26 | A |
2 | C | 7 | D | 12 | A | 17 | B | 22 | C | 27 | D |
3 | C | 8 | B | 13 | C | 18 | A | 23 | D | 28 | D |
4 | C | 9 | C | 14 | D | 19 | B | 24 | A | ||
5 | D | 10 | B | 15 | D | 20 | C | 25 | C |
II. PHẦN TRẮC NGHIỆM TỰ LUẬN (3,0 đ):
CÂU | NỘI DUNG | ĐIỂM |
1 | Câu 1 (1,0 điểm): Viết phương trình hóa học xảy ra (nếu có) giữa các cặp chất sau. Nếu không xảy ra phản ứng thì đánh dấu chéo lên dấu mũi tên. a. Cu + Cl2 b. KBr + Cl2 | 1,0 |
| Mỗi ptpư đúng được 0,5 điểm. Nếu không cân bằng thì trừ 0,25 điểm/1pt | | |
2 | Câu 2 (1,0 điểm): Cho 22,5 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 6,72 lít khí H2 (đktc) và m gam chất rắn không tan. Tính m. | 1,0 |
| Chỉ có Zn phản ứng với dd HCl, chất rắn không tan là Cu PTPƯ: Zn + 2HCl ZnCl2 + H2 Số mol H2 = số mol Zn = 0,3 mol mZn = 19,5 gam m = mCu = 3 gam | 0,25 0,25 0,25 | |
3 | Câu 3 (0,5 điểm): Dung dịch cloramin-B có tác dụng diệt khuẩn mạnh, được sử dụng phổ biến để diệt khuẩn bề mặt ở các khu vực cách ly bệnh nhân và người nghi nhiễm vi rút SARS-CoV-2. Clo cũng là một tác nhân có tính diệt khuẩn mạnh. Có nên dùng clo để thay thế cho dung dịch cloramin-B không? Vì sao? | 0,5 |
| b. Không nên.Vì: - Trong điều kiện thường, Cl2 tồn tại ở thể khí dễ phát tán vào không khí, xâm nhập đường hô hấp gây ngộ độc. - Việc bảo quản và vận chuyển khí clo phức tạp hơn nhiều so với dung dịch cloramin-B. | 0,25 0,25 | |
4 | Câu 4 (0,5 điểm): Hỗn hợp khí X gồm ozon và oxi có tỉ khối đối với hiđro bằng 17,2. Tính phần trăm theo thể tích mỗi khí trong hỗn hợp X. | 0,5 |
| Giả sử số mol của hỗn hợp là 1 mol, số mol của O2 là x mol, suy ra số mol O3 là 1-x. Ta có: 32x+ 48(1-x) = 17,2.2.1= 34,4 => x= 0,85 %O2= 85%; %O3= 15% Học sinh giải cách khác đúng, vẫn cho điểm tối đa. | 0,25 0,25 |
ĐỀ 2 | ĐỀ KIỂM TRA GIỮA HỌC KÌ 2 - NĂM HỌC 2021 –2022 MÔN HÓA 10 |
Cho biết nguyên tử khối: H = 1; O = 16; Cl= 35,5; K = 39; Fe = 56; Cu = 64; Zn = 65.
I. PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1: Khí flo có màu
A. tím đen. B. vàng lục. C. nâu đỏ. D. lục nhạt.
Câu 2: Khi nung nóng, iot rắn chuyển ngay thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là
A. sự ngưng tụ. B. sự thăng hoa. C. sự bay hơi. D. sự phân hủy.
Câu 3: Liên kết giữa nguyên tử hiđro và clo trong phân tử HCl là liên kết
A. cộng hóa trị không cực. B. ion.
C. đôi. D. cộng hóa trị phân cực.
Câu 4: Phát biểu nào sau đây về hiđro clorua là đúng?
A. Ít tan trong nước. B. Có tính axit.
C. Là chất khí ở điều kiện thường. D. Không mùi.
Câu 5: Kim loại nào sau đây không tác dụng với dung dịch axit clohiđric?
A. Fe. B. Al. C. Cu. D. Zn.
Câu 6: Khí G thường được dùng để khử trùng nước sinh hoạt. Khí G là
A. CO2. B. F2. C. O2. D. Cl2.
Câu 7: Clo không phản ứng với chất nào sau đây?
A. NaBr. B. NaOH. C. KCl. D. Ca(OH)2.
Câu 8: Trong phản ứng: Cl2 + H2 2HCl, clo đóng vai trò
A. chất oxi hóa. B. chất tan.
C. chất khử. D. vừa là chất oxi hóa, vừa là chất khử.
Câu 9: Clorua vôi có công thức hóa học là
A. CaOCl2. B. CaCl2. C. CaOCl. D. Ca(OCl)2.
Câu 10: Nước Gia-ven không có ứng dụng nào sau đây?
A. Tẩy uế khu vực bị ô nhiễm. B. Sản xuất chất dẻo. C. Tẩy trắng sợi, vải. D. Sát trùng nhà vệ sinh.
Câu 11: Nước Gia-ven có tính tẩy màu và sát trùng do
A. NaCl có tính khử mạnh. B. NaClO có tính oxi hóa mạnh. C. NaClO có tính khử mạnh. D. NaCl có tính oxi hóa mạnh.
Câu 12: Nhận biết gốc clorua trong dung dịch người ta thường dùng dung dịch
A. Na2SO4. B. Cu(NO3)2. C. Ba(NO3)2. D. AgNO3.
Câu 13: Phát biểu nào sau đây về oxi đúng?
A. Chất khí không màu, không mùi, không vị.
B. Tan nhiều trong nước.
C. Chất khí nhẹ hơn không khí.
D. Dưới áp suất khí quyển, hóa lỏng ở -1120C.
Câu 14: Người ta điều chế oxi trong phòng thí nghiệm bằng cách nào sau đây?
A. Điện phân dung dịch NaOH. B. Nhiệt phân KClO3 với xúc tác MnO2.
C. Chưng cất phân đoạn không khí lỏng. D. Điện phân nước.
Câu 15: Phản ứng tạo ozon từ oxi cần điều kiện
A. nhiệt độ cao. B. áp suất cao.
C. tia lửa điện hoặc tia cực tím. D. xúc tác bột Fe.
Câu 16: Để thu được 6,72 lít O2 (đktc), cần nhiệt phân hoàn toàn a mol tinh thể KClO3. Giá trị của a là
A. 0,10. B. 0,20. C. 0,30. D. 0,15.
Câu 17: Trái cây được bảo quản lâu hơn trong môi trường vô trùng. Trong thực tế, người ta sử dụng nước ozon để bảo quản trái cây. Ứng dụng trên dựa vào tính chất nào sau đây của ozon?
A. Không tác dụng được với nước. B. Trơ về mặt hoá học.
C. Chất khí có mùi đặc trưng. D. Có tính oxi hoá mạnh.
Câu 18: Trong phòng thí nghiệm, để điều chế clo, người ta dùng MnO2 với vai trò là
A. vừa là chất oxi hoá, vừa là chất khử. B. chất xúc tác.
C. chất oxi hoá. D. chất khử.
Câu 19: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm oxi là
A. ns2np6. B. ns2np4. C. ns2np5. D. ns2np3.
Câu 20: Trong bảng hệ thống tuần hoàn, các nguyên tố halogen thuộc nhóm
A. VA. B. VIIA. C. VIA. D. VIIIA.
Câu 21: Ở điều kiện thường, halogen nào sau đây là chất lỏng?
A. Iot. B. Brom. C. Clo. D. Flo.
Câu 22: Phát biểu nào sau đây sai?
A. Halogen là những chất oxi hóa mạnh.
B. Các halogen có tính chất hóa học gần giống nhau.
C. Trong hợp chất, các halogen đều có thể có số oxi hóa: -1; +1; +3; +5; +7.
D. Khả năng oxi hóa của halogen giảm dần từ flo đến iot.
Câu 23: Hòa tan hoàn toàn 22,4 gam bột Fe vào dung dịch HCl dư, thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 2,24. B. 4,48. C. 8,96. D. 17,92.
Câu 24: Trong công nghiệp, khí clo được điều chế từ
A. MnO2. B. HCl. C. NaCl. D. KMnO4.
Câu 25: Thể tích (lít) khí clo cần dùng để phản ứng vừa đủ với dung dịch chứa 0,03 mol NaI là
A. 0,336. B. 3,360. C. 0,672. D. 0,168.
Câu 26: Axit clohiđric thể hiện tính khử trong phản ứng nào sau đây?
A. 2HCl + Na2CO3 2NaCl + CO2 + H2O.
B. 4HCl + MnO2 MnCl2 + Cl2 + 2H2O.
C. 2HCl + MgO MgCl2 + H2O.
D. 2HCl + Ba(OH)2 MgCl2 + 2H2O.
Câu 27: Dãy nào sau đây sắp xếp đúng theo thứ tự tăng dần tính axit của các dung dịch?
A. HCl < HBr < HF < HI. B. HI < HBr < HCl < HF.
C. HF < HCl < HBr < HI. D. HCl < HBr < HI < HF.
Câu 28: Tính chất sát trùng và tẩy màu của clorua vôi là do nguyên nhân nào sau đây?
A. Do trong phân tử có nguyên tử Cl với số oxi hoá +1, thể hiện tính oxi hoá mạnh.
B. Do trong phân tử, gốc ClO- phân huỷ ra oxi nguyên tử có tính oxi hoá mạnh.
C. Do trong phân tử, gốc ClO- phân huỷ ra Cl2 là chất oxi hoá mạnh.
D. Do trong phân tử có nguyên tử Cl với số oxi hoá -1, thể hiện tính oxi hoá mạnh.
II. PHẦN TỰ LUẬN (3,0 điểm)
Câu 1 (1,0 điểm): Viết phương trình hóa học xảy ra (nếu có) giữa các cặp chất sau. Nếu không xảy ra phản ứng thì đánh dấu chéo lên dấu mũi tên.
a. Na + Cl2 b. KI + Br2
Câu 2 (1,0 điểm): Cho 30,0 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Tính m.
Câu 3 (0,5 điểm): Dung dịch muối ăn có khả năng diệt khuẩn, được dùng để súc họng, ngâm rửa rau quả, ... Một học sinh đề xuất sử dụng dung dịch muối ăn để sát khuẩn tay, ngăn chặn sự phát tán của vi rút SARS-CoV-2 thay cho dung dịch rửa tay khô. Đề xuất đó có hợp lý hay không? Vì sao?
Câu 4 (0,5 điểm): Hỗn hợp khí X gồm ozon và oxi có tỉ khối đối với hiđro bằng 17,6. Tính phần trăm theo thể tích mỗi khí trong hỗn hợp X.
----- Hết -----
Học sinh được sử dụng bảng Hệ thống tuần hoàn các nguyên tố hóa học.
ĐÁP ÁN
Học sinh được sử dụng bảng Hệ thống tuần hoàn các nguyên tố hóa học.
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (7,0 đ):
1 | D | 6 | D | 11 | B | 16 | B | 21 | B | 26 | B |
2 | B | 7 | C | 12 | D | 17 | D | 22 | C | 27 | C |
3 | D | 8 | A | 13 | A | 18 | C | 23 | C | 28 | A |
4 | C | 9 | A | 14 | B | 19 | B | 24 | C | ||
5 | C | 10 | B | 15 | C | 20 | B | 25 | A |
CÂU | NỘI DUNG | ĐIỂM |
1 | Câu 1 (1,0 điểm): Viết phương trình hóa học xảy ra (nếu có) giữa các cặp chất sau. Nếu không xảy ra phản ứng thì đánh dấu chéo lên dấu mũi tên. a. Na + Cl2 b. KI + Br2 | 1,0 |
| Mỗi ptpư đúng được 0,5 điểm. Nếu không cân bằng thì trừ 0,25 điểm/1pt | | |
2 | Câu 2 (1,0 điểm): Cho 30,0 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Tính m. | 1,0 |
| Chỉ có Zn phản ứng với dd HCl, chất rắn không tan là Cu PTPƯ: Zn + 2HCl ZnCl2 + H2 Số mol H2 = số mol Zn = 0,4 mol mZn = 26 gam m = mCu = 4 gam | 0,25 0,25 0,25 | |
3 | Câu 3 (0,5 điểm): Dung dịch muối ăn có khả năng diệt khuẩn, được dùng để súc họng, ngâm rửa rau quả, ... Một học sinh đề xuất sử dụng dung dịch muối ăn để sát khuẩn tay, ngăn chặn sự phát tán của vi rút SARS-CoV-2 thay cho dung dịch rửa tay khô. Đề xuất đó có hợp lý hay không? Vì sao? | 0,5 |
| Đề xuất đó không hợp lý.Vì: - Mức độ, tốc độ sát khuẩn của dung dịch NaCl kém và chậm hơn hẳn. - Dung dịch NaCl để lại vết ẩm, chậm bay hơi, sau khi bay hơi để lại cặn trắng. | 0,25 0,25 | |
4 | Câu 4 (0,5 điểm): Hỗn hợp khí X gồm ozon và oxi có tỉ khối đối với hiđro bằng 17,6. Tính phần trăm theo thể tích mỗi khí trong hỗn hợp X. | 0,5 |
| Giả sử số mol của hỗn hợp là 1 mol, số mol của O2 là x mol, suy ra số mol O3 là 1-x. Ta có: 32x + 48(1-x) = 17,6.2.1 = 35,2 => x = 0,8 %O2 = 80%; %O3 = 20% Học sinh giải cách khác đúng, vẫn cho điểm tối đa. | 0,25 0,25 |
ĐỀ 3 | ĐỀ KIỂM TRA GIỮA HỌC KÌ 2 - NĂM HỌC 2021 –2022 MÔN HÓA 10 |
A. PHẦN TRẮC NGHIỆM: (4 điểm)
Câu 1: Thuốc thử dùng để phân biệt hai dung dịch NaI và NaCl là
A. Hồ tinh bột. B. Dung dịch AgNO3.
C. Dung dịch nước vôi trong. D. Quỳ tím.
Câu 2: Cho các dung dịch axit: HCl, HF, HBr, HI. Dung dịch có tính axit mạnh nhất là
A. HCl. B. HF. C. HBr. D. HI.
Câu 3: Trong phản ứng MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O, vai trò của MnO2 là chất
A. môi trường. B. khử. C. bị khử. D. bị oxi hóa.
Câu 4: Hòa tan hoàn toàn 3,6 gam kim loại Mg vào dung dịch HNO3 loãng, giả sử chỉ thu được V lít khí N2 duy nhất (đktc). Giá trị của V là
A. 0,448 lít. B. 4,48 lít. C. 6,72lít. D. 0,672 lít.
Câu 5: Cho khí clo tác dụng với dung dịch X ở nhiệt độ thường thu được Clorua vôi. Dung dịch X là
A. dd KI. B. dd AgNO3. C. dd NaOH. D. dd Ca(OH)2.
Câu 6: Cho 6,72 lít khí clo (đktc) tác dụng hết với m gam nhôm. Giá trị của m là
A. 5,4 gam. B. 2,7 gam. C. 4,05 gam. D. 8,1 gam.
Câu 7: Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa.
(b) Axit flohiđric là axit yếu.
(c) Dung dịch NaF loãng được dùng làm thuốc ngừa sâu răng.
(d) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5, +7
Trong số các phát biểu trên, số phát biểu sai là
A. 4 B. 1 C. 2 D. 3
Câu 8: Số oxi hóa của Clo trong các hợp chất HCl, HClO, KClO3, HClO2 lần lượt là
A. -1, +1, +5, -1. B. -1, +1, +3, -1. C. -1, +1, +5, +3. D. +1, +1, +5, +3.
Câu 9: Cho các phát biểu sau:
(1) Các halogen là những phi kim mạnh nhất trong mỗi chu kỳ.
(2) Các halogen đều tác dụng trực tiếp với oxi.
(3) Các halogen đều có 7 electron lớp ngoài cùng thuộc phân lớp s và p.
(4) Tính oxi hoá của các halogen tăng dần từ flo đến iot.
Số phát biểu sai là
A. 4. B. 1. C. 3. D. 2.
Câu 10: Cho các phản ứng sau
4HCl + PbO2 PbCl2 + Cl2 + 2H2O.
HCl + NH4HCO3 NH4Cl + CO2 + H2O.
2HCl + 2HNO3 2NO2 + Cl2 + 2H2O.
2HCl + Zn ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2. B. 4. C. 3. D. 1.
Câu 11: Cho phản ứng sau: NaXrắn + H2SO4 đặc NaHSO4 + HX khí
Các hiđro halogennua (HX) có thể điều chế theo phản ứng trên là
A. HF, HCl, HBr, HI. B. HCl, HBr, HI. C. HF, HCl. D. HBr, HI.
Câu 12: Halogen X ở điều kiện thường là chất rắn, màu đen tím. X là
A. Cl2. B. I2. C. Br2. D. F2.
Câu 13: Cho hình vẽ mô tả thí nghiệm điều chế clo trong phòng thí nghiệm như sau:
Bình (1) đựng NaCl, bình (2) đựng dung dịch H2SO4 đặc. Vai trò của bình (1) là
A. Giữ lại khí HCl. B. Giữ lại hơi nước.
C. Hòa tan khí Cl2. D. Làm sạch bụi.
Câu 14: Quá trình khử là quá trình
A. nhường proton. B. nhận proton.
C. thu electron. D. nhường electron.
Câu 15: Thể tích khí clo (đktc) thu được khi cho KMnO4 tác dụng hết với dung dịch chứa 0,8 mol HCl (giả thiết hiệu suất đạt 100%) là
A. 4,48 lít. B. 5,6 lít. C. 1,12 lít. D. 8,96 lít.
Câu 16: Cho các kim loại: Na, Zn, Fe, Cu, Ag. Số kim loại phản ứng được với dung dịch HCl là
A. 3. B. 1. C. 4. D. 2.
B. PHẦN TỰ LUẬN: (6 điểm)
Câu 1: (1,0đ) Lập phương trình hóa học của phản ứng sau theo phương pháp thăng bằng electron:
HCl + KMnO4 ® KCl + MnCl2 + Cl2 + H2O
Câu 2: (2,0đ) Viết phương trình hóa học xảy ra (ghi rõ điều kiện phản ứng nếu có) khi cho:
a) Cl2 + H2O b) O2 + I2
c) Ca + F2 d) MgBr2 + AgNO3
Câu 3: (2,0đ) Hòa tan 20 gam hỗn hợp gồm hai kim loại Cu và Al bằng lượng dư dung dịch HCl, sau khi phản ứng hoàn toàn V lít khí H2 (đktc) và còn 3,8 gam kim loại không tan.
a) Tìm % khối lượng mỗi kim loại trong hỗn hợp đầu.
b) Tìm giá trị của V.
Câu 4: (1,0đ) Cho 8,96 lít khí Cl2 (đktc) vào 200 gam dung dịch NaOH 20% ở nhiệt độ thường thu được dung dịch X. Tính khối lượng các chất tan trong dung dịch X.
------ HẾT ------
Lưu ý: 1) Học sinh không được sử dụng Bảng tuần hoàn.
2) Cán bộ coi kiểm tra không được giải thích gì thêm.
- Kế hoạch giảng dạy môn hóa 10
- Đề cương ôn tập lý thuyết chương halogen
- Đề thi hóa 10 học kì 2 có đáp án
- Bài tập trắc nghiệm chương lưu huỳnh theo 4 mức độ
- Đề kiểm tra 1 tiết hóa chương oxi lưu huỳnh
- Câu hỏi trắc nghiệm ôn tập chương oxi lưu huỳnh
- Bài tập trắc nghiệm chương oxi lưu huỳnh
- Bài tập trắc nghiệm hóa 10 chương oxi lưu huỳnh
- số chuyên đề trong chương trình hóa học lớp 10
- Chuyên đề tốc độ phản ứng và cân bằng hóa học LỚP 10
- Đề kiểm tra giữa kì 2 hóa 10 trắc nghiệm
- Đề Thi HSG Hóa 10 Cấp Trường
- Bài tập trắc nghiệm chương phản ứng oxi hóa khử
- Đề Thi Olympic Hóa 10
- Đề Kiểm Tra Học Kì 1 Hóa 10
- Chuyên đề Phản Ứng Hóa Học Lớp 10
- LÝ THUYẾT HÓA HỌC LỚP 10
- Đề thi olympic hóa 10
- ĐỀ THI HỌC SINH GIỎI MÔN HÓA LỚP 10
- Đề Thi Học Kì 1 Hóa 10
- Đề kiểm tra học kì 1 môn hóa 10
- Các dạng đề hóa lớp 10 học kì 1
- ĐỀ KIỂM TRA HỌC KỲ I MÔN HÓA LỚP 10
- ĐỀ KIỂM TRA HÓA HỌC LỚP 10 HỌC KỲ 1
- Đề Thi Học Kì 1 Hóa 10
- Đề thi hóa lớp 10 học kì 1 trắc nghiệm
- Đề Thi Học Kỳ 1 Môn Hóa 10
- Các phương pháp giải nhanh hóa học lớp 10
- Đề Kiểm Tra Giữa Học Kỳ 1 Hóa 10
- Đề cương ôn tập giữa kì 2 hóa 10
- Đề kiểm tra giữa học kì 2 hóa 10
ĐÁP ÁN
Phần đáp án câu trắc nghiệm: 4 điểm
| Mã đề Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
402 | B | D | C | D | D | A | B | C | D | A | C | B | A | C | B | A |
Điểm | Điểm |
| 0,25 đ 0,25đ 0,25đ 0,25đ | Câu 1: +1 -1 +1 +7 -2 +1 -1 +2 -1 0 +1 -2 HCl + KMnO4 ® KCl + MnCl2 + Cl2 + H2O - Chất khử HCl Chất oxi hóa: KMnO4 - Sự oxi hóa -1 0 2Cl ® Cl2 + 2e x5 Sự khử +7 +2 Mn + 5e ® Mn x2 +1 -1 +1 +7 -2 +1 -1 +2 -1 0 +1 -2 16HCl+2KMnO4®2KCl+2MnCl2+5Cl2+ 8H2O |
0,5đ 0,5đ 0,5đ 0,5đ | Câu 2: a) Cl2 + H2O HCl + HClO b) O2 + I2 ® (không pư) c) Ca + F2 ® CaF2 d) MgBr2 + AgNO3 ® 2AgBr + Mg(NO3)2 |
0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ | Câu 3: a) Cu + HCl ® (Không pư) (*) 2Al + 6HCl ® 2AlCl3 + 3H2 (**) mCu= 3,8 gam % mCu = 3,8*100/20 = 19% %mAl = 100 – 19 = 81% b) nAl = 16,2/27 = 0,6 (mol) pt(**) => nH2 = 0,9 (mol) VH2 = 0,9*22,4 = 20,16 lít |
0,25đ 0,25đ 0,25đ 0,25đ | Câu 4: Cl2 + 2NaOH ® NaCl + NaClO + H2O nNaOH > 2 nCl2 => NaOH dư pthh => nNaCl = nNaClO = 0,4 mol mNaCl = 23,4 gam mNaClO = 29,8 gam mNaOH(dư) = 8 gam |
Không tính được NaOH dư thì chỉ chấm điểm phương trình hóa học. |
TỆP ĐÍNH KÈM
Tệp đính kèm đã được mở. Bạn có thể tải tài nguyên dưới đây.
CÁC TỆP ĐÍNH KÈM (2)
- YOPOVN.COM-Bo-de-KT-giua-HK2-Hoa-10.docxDung lượng tệp: 150.8 KB
BẠN MUỐN MUA TÀI NGUYÊN NÀY?
Các tệp đính kèm trong chủ đề này cần được thanh toán để tải. Chi phí tải các tệp đính kèm này là 0 VND. Dành cho khách không muốn tham gia gói THÀNH VIÊN VIP
GIÁ TỐT HƠN
Gói thành viên VIP
- Tải được file ở nhiều bài
- Truy cập được nhiều nội dung độc quyền
- Không quảng cáo, không bị làm phiền
- Tải tài nguyên đề thi, giáo án... từ khối 1-12
- Tải mở rộng sáng kiến, chuyên đề, báo cáo...
- Được tư vấn, hỗ trợ qua zalo 0979.702.422
🔥 Chỉ từ
200K
Mua gói lẻ
- Chỉ tải duy nhất toàn bộ file trong bài đã mua
- Cần mua file ở bài khác nếu có nhu cầu tải
- Tốn kém cho những lần mua tiếp theo
- Được tư vấn, hỗ trợ qua zalo 0979.702.422
0 VND
Sau khi thanh toán thành công, hệ thống sẽ tự động chuyển hướng bạn về trang download tài liệu


 HƯỚNG DẪN ĐĂNG KÝ THÀNH VIÊN THƯỜNG
HƯỚNG DẪN ĐĂNG KÝ THÀNH VIÊN THƯỜNG