Admin Yopo
Ban quản trị Team YOPO
- Tham gia
- 15/8/22
- Bài viết
- 6,066
- Điểm
- 48
tác giả
CHUYÊN ĐỀ BÀI TẬP HÓA HỌC 10 - PHƯƠNG PHÁP BẢO TOÀN ELECTRON được soạn dưới dạng file word/PDF/ powerpoint gồm 8 trang. Các bạn xem và tải về ở dưới.
1.Nguyên tắc : Trong phản ứng oxi hoá-khử, tổng số electron của chất oxi hoá nhận phải bằng tổng số electron của chất khử nhường.
Số Mol chất khử x Số electron nhường = Số Mol chất oxi hoá x Số electron nhận
(Số Mol electron trao đổi)
Dạng 1 : Kim loại tác dụng với chất oxi hoá.
Khi tham gia các phản ứng hoá học, kim loại luôn là chất khử M → Mn+ + ne còn chất kia là chất oxi hoá.
* Kim loại tác dụng với phi kim, khi đó phi kim là chất oxi hoá
Cl2 + 2.1e → 2Cl-
O2 + 2.2e → 2O2-
* Kim loại tác dụng với Axit loãng giải phóng H2, khi đó H+ là chất oxi hoá.
2H+ + 2.1e → H2
* Kim loại tác dụng với HNO3, H2SO4 thì N+5; S+6 là chất oxi hoá.
N+5 + 1e → N+4 2N+5+ 2.4e → 2N+1 (N2O)
N+5 + 3e → N+2 S+6 + 2e → S+4 . . .
1/ Hỗn hợp A gồm bột Fe và Al. Để tác dụng vừa đủ với 11 gam A cần 12,8 gam bột S. Thành phần % số mol của Fe trong A.
a 50% b 37,33% c 33,33% d 66,67%
2/ Cho 1,92 gam Cu tan vừa đủ trong HNO3 loãng thu được V lit NO (đktc). Tính V và khối lượng HNO3 đã phản ứng.
a 0,112 lit; 10,42 g b 0,224 lit; 5,04 g c 0,448 lit; 5,04 g d 1,12lit; 2,92 g
3/ Hoà tan hoàn toàn 13 gam kim loại M trong dd NaOH dư thấy thoát ra 2,24 lit khí (ở 0oC 2atm). Xác định M.
a Al b K c Zn d Na
4/ Cho 5,1 gam hỗn hợp 2 kim loại Al và Mg tác dụng với dd HCl dư thu được 5,6 lit H2 ở đktc. Thành phần % theo khối lượng của Al trong hỗn hợp :
a 50% b 52,94% c 32,94% d 60%
5/ Cho 5,4 gam kim loại R tác dụng hết với H2SO4 đặc thu được 1,68 lit H2S duy nhất (đktc). Xác định R.
a Al b Cu c Fe d Mg
6/ Hoà tan hoàn toàn m gam Al vào dd HNO3 loãng dư thu được dd X và 1,12 lit hỗn hợp khí gồm N2O, NO (đktc) có tỉ khối so với oxi bằng 1,2. Cho dd NaOH dư vào dd X đun nhẹ thấy có 0,336 lit khí (đktc) thoát ra. Tính m.
a 5,4 g b 8,1 g c 5,94 g d 3,78 g
7/ Cho 11,88 gam kim loại M tác dụng hết với HNO3 đun nóng giải phóng 0,15 mol hỗn hợp N2O và N2 có d/H2 = 18,8. M là ;
a Zn b Al c Mg d Fe
8/ Hoà tan hoàn toàn m gam Al vào dd HNO3 loãng dư thu được hỗn hợp khí gồm 0,015 mol N2O và 0,01 mol NO (phản ứng không tạo muối amoni). Tính m.
a 8,1 g b 1,35 g c 13,5 g d 0,81 g
9/ Cho 10,8 gam một kim loại tác dụng hoàn toàn với khí Clo thu được 53,4 gam muối Clorua. Xác định kim loại.
a Mg b Fe c Al d Cu
10/ Cho 8,3 gam hỗn hợp Al và Fe tác dụng hết với H2SO4 đặc dư thu được 6,72 lit khí SO2 ở đktc. Tính khối lượng mỗi kim loại trong hỗn hợp.
a 1,35 g và 6,95 g b 3,6 g và 4,7 g c 2,7 g và 5,6 g d 5,4 g và 2,9 g
11/ Cho 5,6 gam Fe tan hết trong dd HNO3 thu được 21,1 gam muối và V lit NO2 (đktc). Tính V.
a 5,6 lit b 6,72 lit c 3,36 lit d 4,48 lit
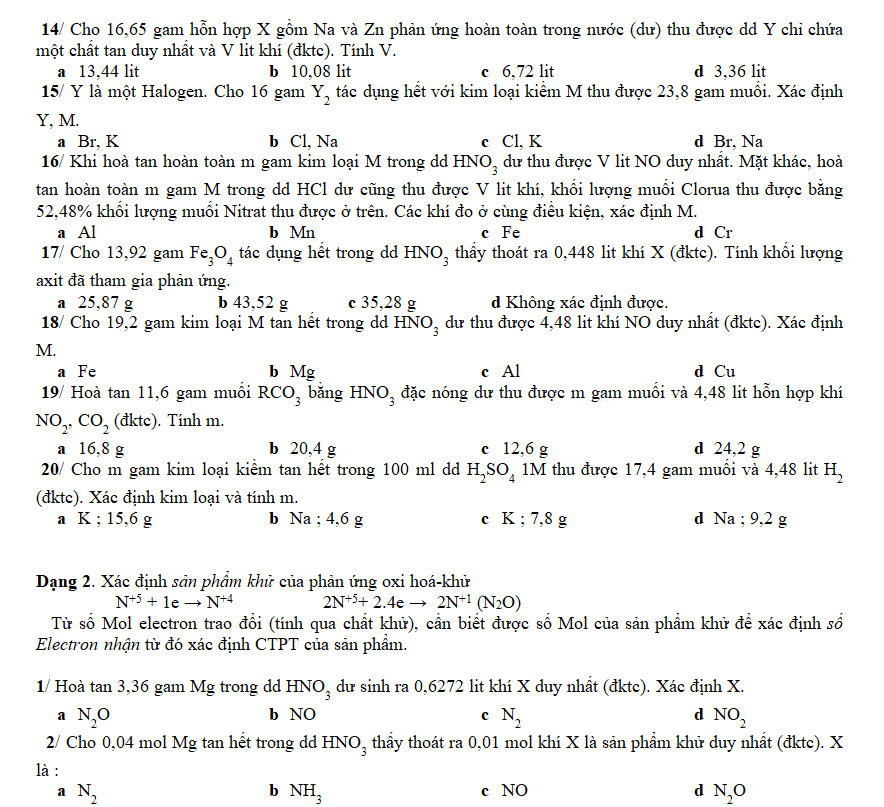
1.Nguyên tắc : Trong phản ứng oxi hoá-khử, tổng số electron của chất oxi hoá nhận phải bằng tổng số electron của chất khử nhường.
Số Mol chất khử x Số electron nhường = Số Mol chất oxi hoá x Số electron nhận
(Số Mol electron trao đổi)
Dạng 1 : Kim loại tác dụng với chất oxi hoá.
Khi tham gia các phản ứng hoá học, kim loại luôn là chất khử M → Mn+ + ne còn chất kia là chất oxi hoá.
* Kim loại tác dụng với phi kim, khi đó phi kim là chất oxi hoá
Cl2 + 2.1e → 2Cl-
O2 + 2.2e → 2O2-
* Kim loại tác dụng với Axit loãng giải phóng H2, khi đó H+ là chất oxi hoá.
2H+ + 2.1e → H2
* Kim loại tác dụng với HNO3, H2SO4 thì N+5; S+6 là chất oxi hoá.
N+5 + 1e → N+4 2N+5+ 2.4e → 2N+1 (N2O)
N+5 + 3e → N+2 S+6 + 2e → S+4 . . .
1/ Hỗn hợp A gồm bột Fe và Al. Để tác dụng vừa đủ với 11 gam A cần 12,8 gam bột S. Thành phần % số mol của Fe trong A.
a 50% b 37,33% c 33,33% d 66,67%
2/ Cho 1,92 gam Cu tan vừa đủ trong HNO3 loãng thu được V lit NO (đktc). Tính V và khối lượng HNO3 đã phản ứng.
a 0,112 lit; 10,42 g b 0,224 lit; 5,04 g c 0,448 lit; 5,04 g d 1,12lit; 2,92 g
3/ Hoà tan hoàn toàn 13 gam kim loại M trong dd NaOH dư thấy thoát ra 2,24 lit khí (ở 0oC 2atm). Xác định M.
a Al b K c Zn d Na
4/ Cho 5,1 gam hỗn hợp 2 kim loại Al và Mg tác dụng với dd HCl dư thu được 5,6 lit H2 ở đktc. Thành phần % theo khối lượng của Al trong hỗn hợp :
a 50% b 52,94% c 32,94% d 60%
5/ Cho 5,4 gam kim loại R tác dụng hết với H2SO4 đặc thu được 1,68 lit H2S duy nhất (đktc). Xác định R.
a Al b Cu c Fe d Mg
6/ Hoà tan hoàn toàn m gam Al vào dd HNO3 loãng dư thu được dd X và 1,12 lit hỗn hợp khí gồm N2O, NO (đktc) có tỉ khối so với oxi bằng 1,2. Cho dd NaOH dư vào dd X đun nhẹ thấy có 0,336 lit khí (đktc) thoát ra. Tính m.
a 5,4 g b 8,1 g c 5,94 g d 3,78 g
7/ Cho 11,88 gam kim loại M tác dụng hết với HNO3 đun nóng giải phóng 0,15 mol hỗn hợp N2O và N2 có d/H2 = 18,8. M là ;
a Zn b Al c Mg d Fe
8/ Hoà tan hoàn toàn m gam Al vào dd HNO3 loãng dư thu được hỗn hợp khí gồm 0,015 mol N2O và 0,01 mol NO (phản ứng không tạo muối amoni). Tính m.
a 8,1 g b 1,35 g c 13,5 g d 0,81 g
9/ Cho 10,8 gam một kim loại tác dụng hoàn toàn với khí Clo thu được 53,4 gam muối Clorua. Xác định kim loại.
a Mg b Fe c Al d Cu
10/ Cho 8,3 gam hỗn hợp Al và Fe tác dụng hết với H2SO4 đặc dư thu được 6,72 lit khí SO2 ở đktc. Tính khối lượng mỗi kim loại trong hỗn hợp.
a 1,35 g và 6,95 g b 3,6 g và 4,7 g c 2,7 g và 5,6 g d 5,4 g và 2,9 g
11/ Cho 5,6 gam Fe tan hết trong dd HNO3 thu được 21,1 gam muối và V lit NO2 (đktc). Tính V.
a 5,6 lit b 6,72 lit c 3,36 lit d 4,48 lit




