- Tham gia
- 28/1/21
- Bài viết
- 85,996
- Điểm
- 113
tác giả
DANH SÁCH Đề thi thử hóa học kì 2 lớp 12 CÓ ĐÁP ÁN NĂM 2022 MỚI NHẤT
YOPOVN xin gửi đến quý thầy cô, các em học sinh DANH SÁCH Đề thi thử hóa học kì 2 lớp 12 CÓ ĐÁP ÁN NĂM 2022 MỚI NHẤT. Đây là bộ Đề thi thử hóa học kì 2 lớp 12.
De thi học kì 2 lớp 12 môn Hóa trắc nghiệm có đáp an
Đề thi Hóa 12 học kì 2
Đề thi học kì 2 môn Hóa lớp 12 có đáp an Đồng Nai
Hóa 12 học kì 2 tử bài nào
Đề thi Hóa học kì 2 lớp 12 Quảng Nam
Hóa học kì 2 lớp 12 tử Bài nào
Đề Minh Hóa học kì 2 lớp 12
De thi Hóa 12 có đáp an
De thi giữa học kì 2 lớp 12 môn Hóa trắc nghiệm có đáp an
De thi Hóa HK2 lớp 12 có đáp an
Hóa 12 học kì 2 tử bài nào
Lý thuyết Hóa 12 học kì 2
De thi học kì 1 Hóa 12 có lời giải
De thi Hóa 12 có đáp an
Hóa học kì 2 lớp 12 tử Bài nào
Đề thi học kì 2 môn Hóa lớp 12 có đáp an Đồng Nai
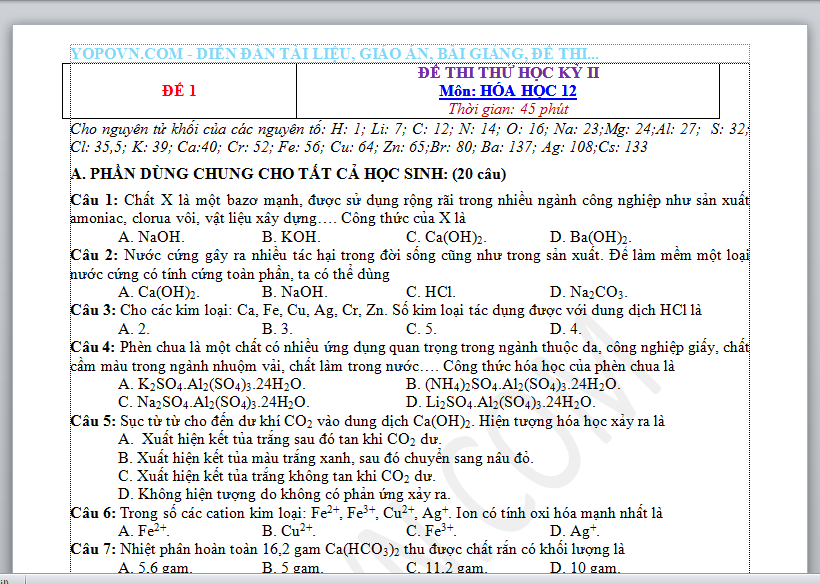
Cho nguyên tử khối của các nguyên tố: H: 1; Li: 7; C: 12; N: 14; O: 16; Na: 23;Mg: 24;Al: 27; S: 32; Cl: 35,5; K: 39; Ca:40; Cr: 52; Fe: 56; Cu: 64; Zn: 65;Br: 80; Ba: 137; Ag: 108;Cs: 133
A. PHẦN DÙNG CHUNG CHO TẤT CẢ HỌC SINH: (20 câu)
Câu 1: Chất X là một bazơ mạnh, được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất amoniac, clorua vôi, vật liệu xây dựng…. Công thức của X là
A. NaOH. B. KOH. C. Ca(OH)2. D. Ba(OH)2.
Câu 2: Nước cứng gây ra nhiều tác hại trong đời sống cũng như trong sản xuất. Để làm mềm một loại nước cứng có tính cứng toàn phần, ta có thể dùng
A. Ca(OH)2. B. NaOH. C. HCl. D. Na2CO3.
Câu 3: Cho các kim loại: Ca, Fe, Cu, Ag, Cr, Zn. Số kim loại tác dụng được với dung dịch HCl là
A. 2. B. 3. C. 5. D. 4.
Câu 4: Phèn chua là một chất có nhiều ứng dụng quan trọng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước…. Công thức hóa học của phèn chua là
A. K2SO4.Al2(SO4)3.24H2O. B. (NH4)2SO4.Al2(SO4)3.24H2O.
C. Na2SO4.Al2(SO4)3.24H2O. D. Li2SO4.Al2(SO4)3.24H2O.
Câu 5: Sục từ từ cho đến dư khí CO2 vào dung dịch Ca(OH)2. Hiện tượng hóa học xảy ra là
A. Xuất hiện kết tủa trắng sau đó tan khi CO2 dư.
B. Xuất hiện kết tủa màu trắng xanh, sau đó chuyển sang nâu đỏ.
C. Xuất hiện kết tủa trắng không tan khi CO2 dư.
D. Không hiện tượng do không có phản ứng xảy ra.
Câu 6: Trong số các cation kim loại: Fe2+, Fe3+, Cu2+, Ag+. Ion có tính oxi hóa mạnh nhất là
A. Fe2+. B. Cu2+. C. Fe3+. D. Ag+.
Câu 7: Nhiệt phân hoàn toàn 16,2 gam Ca(HCO3)2 thu được chất rắn có khối lượng là
A. 5,6 gam. B. 5 gam. C. 11,2 gam. D. 10 gam.
Câu 8: Cho 8,4 gam sắt tác dụng với dung dịch HNO3 đặc nóng dư, thể tích khí NO2 (sản phẩm khử duy nhất, ở đktc) thu được sau phản ứng là
A. 3,36 lít. B. 10,08 lít. C. 5,04 lít. D. 6,72 lít.
Câu 9: Cấu hình electron lớp ngoài cùng của các kim loại kiềm có dạng
A. ns2np1. B. ns1. C. ns2np5. D. ns2.
Câu 10: Kim loại cứng nhất là
A. Cr. B. W. C. Ag. D. Fe.
Câu 11: Hiện tượng nào dưới đây được mô tả không đúng?
A. Thêm Fe(OH)3 màu đỏ nâu vào dung dịch H2SO4 thấy hình thành dung dịch có màu vàng nâu.
B. Thêm NaOH vào dung dịch FeCl3 màu vàng nâu thấy xuất hiện kết tủa đỏ nâu.
C. Thêm một ít bột Fe vào dung dịch AgNO3 dư thấy xuất hiện dung dịch có màu xanh nhạt.
D. Thêm Cu vào dung dịch Fe(NO3)3 thấy dung dịch chuyển từ màu vàng nâu sang màu xanh lam.
Câu 12: Cho các hợp kim: Fe–Cu; Fe–C; Zn–Fe; Mg–Fe tiếp xúc với không khí ẩm. Số hợp kim trong đó Fe bị ăn mòn điện hóa là
A. 1. B. 3. C. 4. D. 2.
Câu 13: Trong phòng thí nghiệm, để xử lí sơ bộ một số chất thải ở dạng dung dịch chứa ion Fe3+ và Cu2+ ta có thể dùng lượng dư
A. dung dịch muối ăn. B. nước vôi trong.
C. ancol etylic. D. giấm ăn.
Câu 14: Điện phân nóng chảy 14,9 gam muối clorua của kim loại M thu được 2,24 lít khí Cl2 (ở đktc). Công thức của muối clo rua đã điện phân là
A. NaCl. B. CaCl2. C. KCl. D. MgCl2.
Câu 15: Sắt (Fe) ở ô số 26 của bảng tuần hoàn các nguyên tố hóa học. Cấu hình electron của ion Fe2+ là
A. [Ar]3d64s2. B. [Ar]3d6. C. [Ar] 3d44s2. D. [Ar] 3d54s1.
Câu 16: Tiến hành 3 thí nghiệm như hình vẽ sau (chất lỏng trong các cốc đều là dung dịch H2SO4 loãng với nồng độ bằng nhau):
Cốc (1) Cốc (2) Cốc (3)
Nhận định đúng về các thí nghiệm trên là
A. Cốc (3) không xảy ra ăn mòn điện hóa học.
B. Cả ba cốc sắt đều bị ăn mòn.
C. Cốc (3) sắt không bị ăn mòn.
D. Tốc độ ăn mòn sắt ở cốc (1) nhanh hơn cốc (2).
Câu 17: Kim loại nhôm không phản ứng với
A. dung dịch H2SO4 loãng, nguội. B. dung dịch NaOH.
C. dung dịch HCl. D. dung dịch H2SO4 đặc, nguội.
Câu 18: Cho m gam hỗn hợp nhôm và magiê tác dụng với dung dịch HCl dư thu được 10,08 lít khí H2 (đktc). Nếu cho m gam hỗn hợp trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít khí (đktc). Giá trị của m là
A. 9,0 gam. B. 10,2 gam. C. 7,8 gam. D. 7,5 gam.
Câu 19: Cho các chất: Al, AlCl3, Al2O3, Al(OH)3. Số chất vừa tác dụng với dụng dịch HCl, vừa tác dụng với dung dịch NaOH là
A. 1. B. 3. C. 2. D. 4.
Câu 20: Nhận xét nào sau đây sai?
A. Những tính chất vật lí chung của kim loại chủ yếu do các electron tự do trong mạng tinh thể kim loại gây ra.
B. Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử.
C. Tính chất hóa học chung của kim loại là tính oxi hóa.
D. Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng.
B. PHẦN RIÊNG: (10 câu)
I. DÀNH RIÊNG CHO HỌC SINH KHOA HỌC XÃ HỘI:
Câu 21: Cho các chất và ion sau: Fe; FeSO4; Fe2(SO4)3; FeCl2; Fe2+; Fe3+. Số lượng chất và ion có khả năng đóng vai trò chất khử là
A. 3. B. 2. C. 5. D. 4.
Câu 22: Cho 7,8 gam hỗn hợp gồm Al, Mg tác dụng với dung dịch HCl dư rồi cô cạn cẩn thận dung dịch sau phản ứng thì thu được 36,2 gam hỗn hợp muối khan. Thể tích khí H2 thu được (ở đktc) là
A. 6,72 lít. B. 8,96 lít. C. 4,48 lít. D. 7,84 lít.
Câu 23: Cho m gam Cu tác dụng với dung dịch HNO3 loãng dư. Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí NO (sản phẩm khử duy nhất ở đktc) và dung dịch X. Khối lượng muối khan thu được khi cô cạn dung dịch X là
A. 37,6 gam. B. 28,2 gam. C. 9,6 gam. D. 18,8 gam.
Câu 24: Chọn phát biểu sai
A. Tất cả kim loại kiềm thổ đều có hai electron ở lớp ngoài cùng.
B. Điều chế kim loại kiềm thổ bằng phương pháp điện phân nóng chảy.
C. Kim loại kiềm thổ có tính khử mạnh, chỉ kém kim loại kiềm.
D. Hiđroxit của tất cả kim loại kiềm thổ đều tan tốt trong nước.
Câu 25: Dẫn 3,36 lít khí CO2 (ở đktc) vào 300 mililit dung dịch NaOH 0,5M thu được dung dịch X. Cô cạn cẩn thận dung dịch X thu được khối lượng muối khan là
A. 12,6 gam. B. 15,9 gam. C. 8,4 gam. D. 7,95 gam.
Câu 26: Kim loại có thể khử Cu2+ trong dung dịch CuSO4 thành Cu đơn chất là
A. Ag. B. K. C. Zn. D. Ca.
Câu 27: Khử hoàn toàn 11,52 gam oxit sắt cần vừa đủ 4,8384 lít khí CO (đktc). Oxit sắt đã dùng là
A. FeO. B. Fe2O3 hoặc FeO. C. Fe2O3. D. Fe3O4.
Câu 28: Nhóm các kim loại có thể điều chế bằng phương pháp nhiệt luyện là
A. Fe, Cu, Ag. B. K, Al, Cu. C. Li, Cu, Ag. D. Al, Fe, Cu.
Câu 29: Cho từ từ dung dịch NaOH vào 500 mililit dung dịch hỗn hợp Al2(SO4)3 0,2M và FeCl3 0,2 M, khối lượng kết tủa thu được lớn nhất là
A. 15,6 gam. B. 26,3 gam. C. 18,5 gam. D. 10,7 gam.
Câu 30: Chọn phương trình hóa học sai
A. 2Fe + 6HCl à 2FeCl3 + 3H2.
B. NaHCO3 + Ca(OH)2 à CaCO3 + NaOH + H2O.
C. 2NaOH + 2Al + 2H2O à 2NaAlO2 + 3H2.
D. Zn + 4HCl à ZnCl2 + H2O.
II. DÀNH RIÊNG CHO HỌC SINH KHOA HỌC TỰ NHIÊN:
Câu 31: Chọn phương trình hóa học sai
A. NaHCO3 + NaOH à Na2CO3 + H2O.
B. Na2CO3 + Ca(HCO3)2 à CaCO3 + 2NaHCO3.
C. NaOH + Ca(HCO3)2 à NaOH + CaCO3 + H2O.
D. 2Na + H2O à Na2O + H2.
Câu 32: Khử hoàn toàn m gam oxit MxOy cần vừa đủ 17,92 lít khí CO (đktc), thu được a gam kim loại M. Hòa tan hết a gam M bằng dd H2SO4 đặc, nóng, dư, thu được 20,16 lít khí SO2 (sản phẩm khử duy nhất ở đktc). Oxit kim loại đã dùng là
A. CuO. B. Fe2O3. C. Cr2O3. D. Fe3O4.
Câu 33: Cho các thí nghiệm sau đây:
Cho dung dịch NaOH đến dư vào dung dịch Mg(NO3)2.
Cho dung dịch NH3 đến dư vào dung dịch AlCl3.
Cho dung dịch HCl đến dư vào dung dịch NaAlO2.
Thổi CO2 đến dư vào dung dịch Ca(OH)2.
Cho bột Mg vào dung dịch FeCl3 dư.
Số thí nghiệm thu được kết tủa sau phản ứng là
A. 2. B. 4. C. 3. D. 1.
Câu 34: Cho các chất và ion sau: Fe; FeSO4; Fe2(SO4)3; FeCl2; Fe2+; Fe3+. Số lượng chất và ion có khả năng vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là
A. 2. B. 4. C. 5. D. 3.
Câu 35: Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hỗn hợp gồm x mol AlCl3 và y mol FeCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Tỉ lệ x:y là
A. 2:3. B. 2:1. C. 1:1. D. 3:1.
Câu 36: Cho 2,16 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (ở đktc) và dung dịch X. Khối lượng muối khan thu được khi cô cạn dung dịch X là
A. 13,32 gam. B. 13,92 gam. C. 9,6 gam. D. 18,12 gam.
Câu 37: Hỗn hợp X gồm Fe(NO3)2, Cu(NO3)2 và AgNO3. Thành phần % khối lượng của nitơ trong X là 11,864%. Từ 70,8 gam X có thể điều chế tối đa m gam hỗn hợp kim loại. Giá trị của m là
A. 16,8 gam. B. 52,8 gam. C. 33,6 gam. D. 38,4 gam.
Câu 38: Cho 24,12 gam hỗn hợp X gồm CuO , Fe2O3 , Al2O3 tác dụng vừa đủ với 350ml dd HNO3 4M rồi cô cạn cẩn thận dung dịch sau phản ứng thì thu được m gam hỗn hợp muối khan. Giá trị của m là
A. 99,72 gam. B. 86,80 gam. C. 110,92 gam. D. 77,92 gam.
Câu 39: Dẫn 1,288 lít khí CO2 (ở đktc) vào 400 mililit dung dịch hỗn hợp Ca(OH)2 0,05M và NaOH 0,075M thấy có m gam kết tủa. Giá trị của m là
A. 1,25 gam. B. 1,75 gam. C. 2 gam. D. 5,75 gam.
Câu 40: Cho m gam kim loại Na vào 200 mililit dung dịch HCl 1M, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được 35,1 gam chất rắn khan. Giá trị gần nhất của m là
A. 24 gam. B. 18 gam. C. 14 gam. D. 28 gam.
Câu 1: Các chất đều tác dụng với dung dịch Ca(OH)2 gồm
A CO2, HNO3, NaNO3. B NaHCO3, CO2, CH3NH2 C NH4NO3, Ca(HCO3)2, Na2CO3. D CO2, NaCl, Na2CO3.
Câu 2: Có 4 dung dịch: Na2CO3, NaOH, NaCl, HCl. Nếu chỉ dùng thêm quỳ tím thì có thể nhận biết được
A 3dung dịch. B 4 dung dịch. C 1dung dịch. D 2 dung dịch.
Câu 3: Cho 14,4gam hỗn hợp Fe, Cu tác dụng với dung dịch HCl dư, sau phản ứng thu được 4,48 lít khí (đktc). Khối lượng của Cu trong hỗn hợp là
A 3,2 gam B 64,0 gam C 6,4 gam D 0,64 gam
Câu 4: Cho hỗn hợp CaO, MgO, Na2CO3, Fe3O4 tan vào nước ta thu được chất rắn gồm
A CaCO3, MgO, Fe3O4 B Na2CO3, Fe3O4. C MgO, Fe3O4. D CaO, MgO, Fe3O4.
Câu 5: Có 3 cốc nước : nước cất, nước cứng tạm thời (chứa Ca(HCO3)2), nước cứng vĩnh cửu (chứa CaSO4). Phương pháp nhận biết 3 cốc nước trên là
A đun nóng và dùng dung dịch Na2CO3. B đun nóng, sau đó dùng dung dịch nước vôi. C dùng quỳ tím, dùng dung dịch HCl. D dùng dung dịch HCl, sau đó đun nhẹ.
Câu 6: Cho hỗn hợp Al, Fe vào dung dịch chứa hỗn hợp Cu(NO3)2 và AgNO3, sau phản ứng thu được hỗn hợp rắn gồm 3 kim loại. Ba kim loại đó là
A Al, Fe, Ag B Al, Fe, Cu C Ag, Cu, Fe D Ag, Cu, Al
Câu 7: .Mô tả nào dưới đây không phù hợp với nhôm?
A mức oxi hóa đặc trưng trong hợp chất là +3 B nhôm ở ô thứ 13, chu kì 2, nhóm IIIA C tinh thể cấu tạo lập phương tâm diện D cấu hình e rút gọn: [Ne] 3s2 3p1
Câu 8: Dung dịch FeSO4 có lẫn CuSO4. Để loại bỏ tạp chất có thể dùng một lượng dư
A Al B Cu C Ag D Fe
Câu 9: Sục khí CO2 dư vào dung dịch muối X thu được kết tủa trắng. Nhỏ từ từ dung dịch HCl vào dung dịch muối X đặc dư, thấy xuất hiện kết tủa trắng sau đó kết tủa tan dần. Muối X là
A C6H5ONa B BaCl2 C NaAlO2 D AlCl3
Câu 10: Cho Na vào 300ml dung dịch AlCl3. Khi phản ứng kết thúc thu được 5,6 lít khí H2 (đktc), dung dịch A và kết tủa B. Lọc lấy kết tủa đem nung đến khối lượng không đổi thu được 5,1 gam chất rắn D. Nồng độ mol của dung dịch AlCl3 là
A 0,8 M B 0.5 M C 0,4 M D 0,6 M
Câu 11: Cho 6 gam kim loại kiềm thổ tác dụng hết với nước thu được 12,22 lít khí (ở 250C; 0,5atm). Kim loại kiềm thổ đã dùng là
A Mg B Sr C Ba D Ca
Câu 12: Phát biểu sai là: Fe có khả năng tan trong dung dịch
A FeCl3 B AgNO3 C FeCl2 D CuSO4
Câu 13: Phương trình hóa học viết sai là
A Fe + Cl2 FeCl2 B 3Fe + 2O2 Fe3O4 C Fe (dư) + 2AgNO3 Fe(NO3)2 + 2Ag D Fe + 2HCl FeCl2 + H2
Câu 14: Cho a mol NaAlO2 tác dụng với dung dịch có chứa b mol HCl. Điều kiện của a và b để xuất hiện kết tủa là
A b 4a B b> 4a C b = 4a D b < 4a
Câu 15: Cho 7.8gam kim loại kiềm M tác dụng với lượng nước (dư) sinh ra 2,24 lít H2 (đktc). Kim loại M là
A Ba B Na C Ca D K
Câu 16: Phản ứng giữa Al(OH)3 với dung dịch xút thuộc loại phản ứng
A phân hủy B oxi hóa - khử C axit - bazơ D thế
Câu 17: Để bảo quản dung dịch Fe2(SO4)3, tránh hiện tượng thủy phân người ta thường nhỏ vào ít giọt dung dịch
A NH3. B H2SO4. C BaCl2. D NaOH.
Câu 18: Cho sơ đồ chuyển hóaH2 (A)KAlO2(B)(C)(A). Các chất A, B, C lần lượt là
A K, Al(OH)3, Al2O3 B Al, KHCO3, Al2O3 C Al2O3, Al(OH)3, Al D Al, Al(OH)3, Al2O3
Câu 19: Cho 33.9 gam hỗn hợp bột nhôm oxit và nhôm tác dụng vừa đủ với 675 ml dung dịch HCl 4M. Khối lượng nhôm trong hỗn hợp ban đầu là
A 6,75 gam B 10,20 gam. C 11,85 gam. D 13,5gam
Câu 20: Dẫn 8,96 lít khí CO2 (đktc) vào 350 ml dung dịch Ca(OH)2 1M. Khối lượng kết tủa thu được là
A 15 gam. B 30 gam. C 20 gam. D 25 gam.
Câu 21: Cho phản ứng Fe + Cu2+ Fe2+ + Cu. Nhận xét không đúng là
A ion Fe2+ oxi hóa được kim loại Cu. B kim loại Fe khử được ion Cu2+ C tính oxi hóa của ion Fe2+ yếu hơn ion Cu2+ D kim loại Fe có tính khử mạnh hơn kim loại Cu.
Câu 22: Cho hỗn hợp kim loại gồm Na và Al vào nước, thu được dung dịch và 4,48 lít khí (đktc), 2.7 gam chất rắn. Khối lượng của Na và Al tương ứng là
A 7,8 gam và 5,4 gam B 2.3 gam và 5,4 gam C 3,9 gam và 8,1 gam D 15,6 gam và 5,4 gam
Câu 23: Chất nào sau đây không có tính lưỡng tính?
A NaHCO3 B Al(OH)3 C ZnSO4 D Al2O3
Câu 24: Oxi hóa 11,2 gam Fe bằng oxi được m gam hỗn hợp Y gồm Fe, FeO, Fe3O4, Fe2O3. Y tan hết trong HNO3 dư, sinh ra 0,06 mol NO (sản phẩm khử duy nhất). Giá trị của m là
A 7,56 B 6,56 C 5,66 D 14,56
Câu 25: Khử hoàn toàn m gam hỗn hợp X gồm FeO và Fe2O3 bằng H2 (t0), kết thúc thí nghiệm thu được 12,6 gam nước và 28 gam Fe. Phần trăm khối lượng FeO có trong X là
A 47,4%. B 18,4% C 27,8%. D 52,6%.
Câu 26: Để bảo quản kim loại kiềm, người ta
A ngâm chìm trong dầu hoả. B ngâm chìm vào dung dịch NaOH C cho vào lọ đậy kín. D ngâm chìm trong dung dịch muối ăn.
Câu 27: Cho Na vào dung dịch CuSO4 dư, dung dịch thu được sau phản ứng chứa các chất tan là
A Na2SO4, CuSO4, Cu(OH)2 B Na2SO4, Cu(OH)2 C Na2SO4, CuSO4. D Na2SO4, CuSO4, NaOH
Câu 28: Cho luồng khí CO dư đi qua ống sứ chứa hỗn hợp các chất sau: CaO, Al2O3, Fe2O3, CuO, nung nóng. Chất rắn còn lại trong ống sứ gồm
A Al, CaCO3, Fe, Cu. B Al2O3, Fe, Cu, CaO. C CaCO3, Al2O3, Fe, Cu. D Al2O3, Cu, Fe2O3, CaO.
Câu 29: Khi điện phân dung dịch NaCl, ở anot xảy ra
A sự khử Cl- B sự oxi hoá H2O C sự khử H2O D sự oxi hóa Cl-
Câu 30: X là hỗn hợp Al(OH)3, Ag2O, Cu(OH)2 và Zn(OH)2. Để tách Al(OH)3 ra khỏi hỗn hợp X, người ta cho X vào dung dịch
A HCl dư, sau đó cho dung dịch NaOH dư vào thì Al(OH)3 tách ra. B NaOH dư, sau đó cho dung dịch NH3 vừa đủ vào thì Al(OH)3 tách ra C NH3 dư, Al(OH)3 không tan tách ra D HCl dư, sau đó trung hòa axit dư băng dung dịch kiềm thì Al(OH)3 tách ra.
Câu 31: Nhóm các chất đều tác dụng được với Mg là
A H2SO4, Cl2, C2H5OH, O2. B HNO3, CH3COOH, O2, CuSO4. C H2O, HCl, O2, NaNO3 D HNO3, KOH, O2, S.
Câu 32: Các muối FeSO4, Fe2(SO4)3, KNO3, Na2CO3 có cùng nồng độ mol. Thứ tự pH tăng dần của chúng là
A KNO3 < Na2CO3 < FeSO4 < Fe2(SO4)3 B FeSO4 < Fe2(SO4)3 < KNO3 < Na2CO3 C Na2CO3 < KNO3 < FeSO4 < Fe2(SO4)3 D Fe2(SO4)3 < FeSO4 < KNO3 < Na2CO3
Nâng cao
Câu 33: Khi trộn lẫn các dung dịch FeCl3 và dung dịch Na2CO3 thì thấy có kết tủa
A đỏ nâu B đỏ nâu và sủi bọt khí C trắng D trắng và sủi bọt khí
Câu 34: Một dung dịch hỗn hợp chứa a mol NaAlO2 và a mol NaOH tác dụng với một dung dịch chứa b mol HCl. Điều kiện để thu được kết tủa sau phản ứng là:
A a < b < 5a B a = b C b = 5a D a = 2b
Câu 35: Cho Fe vào dung dịch AgNO3 loãng, dư thu được dung dịch (A) có chứa
A Fe(NO3)2 B Fe(NO3)2, AgNO3 C Fe(NO3)3, AgNO3 D Fe(NO3)3
Câu 36: Cho hỗn hợp Fe dư và Cu vào dung dịch HNO3 loãng thu được khí NO và dung dịch chứa
A Fe(NO3)2 B Fe(NO3)2, Fe(NO3)3 C Fe(NO3)2, Cu(NO3)2 D Fe(NO3)3
Câu 37: Nguyên tắc làm mềm nước cứng là
A đun nóng hoặc dùng hoá chất. B loại bỏ bớt ion Ca2+ và Mg2+ trong nước. C làm các muối tan của magie và canxi biến thành muối kết tủa. D dùng cột trao đổi ion.
Câu 38: Cho dung dịch chứa x gam Ba(OH)2 vào dung dịch chứa x gam HCl. Dung dịch thu được sau phản ứng có môi trường
A không xác định được. B axit. C trung tính. D bazơ.
Câu 39: A là dung dịch gồm 0,075 mol CuSO4 và 0,2 mol NaCl. Điện phân dung dịch A (điện cực trơ, màng ngăn xốp ) cho đến khi nước vừa bắt đầu điện phân ở cả hai điện cực thì ngừng lại. Dung dịch sau điện phân hòa tan vừa đủ x gam ZnO. Giá trị của x là
A 8,10 B 12,15 C 4,05 D 2,025
Câu 40: Dung dịch X chứa ion H; 0,02 mol Al3+; 0,01 mol Mg2+ và 0,045 mol SO. Thêm 0,045 mol NaOH và 0,03 mol Ba(OH)2 vào dung dịch X rồi khuấy đều. Khối lượng kết tủa thu được sau phản ứng là
A 9,13 gam B 1,36 gam C 8,35 gam D 7,96gam
Phần riêng
Cơ bản:
Câu 41: Cho Ca vào dung dịch NH4HCO3 thấy xuất hiện
A kết tủa trắng và khí mùi khai bay lên. B khí mùi khai bay lên. C kết tủa trắng. D kết tủa trắng sau đó tan dần.
Câu 42: Hỗn hợp Fe và Cu tác dụng với dung dịch HNO3 loãng, phản ứng xong thu được dung dịch A chỉ chứa một chất tan. Chất tan đó là
A Fe(NO3)2. B Cu(NO3)2. C HNO3. D Fe(NO3)3.
Câu 43: X là hỗn hợp bột gồm Cu, Ni, Sn, Zn. Cho X vào dung dịch AgNO3 khuấy đều, phản ứng xong được chất rắn Y gồm 3 kim loại. Kim loại trong Y là
A Ag, Cu, Ni B Zn, Ni, Sn C Zn, Ni, Cu D Ag, Cu, Sn
Câu 44: Hòa tan hết 19.2 gam hỗn hợp Mg, Al và Fe trong dung dịch H2SO4 thu được 38,4 gam muối sunfat. Cho lượng muối này tác dụng với dung dịch BaCl2 dư thì khối lượng kết tủa thu được là
A 32,62 gam. B 23,30 gam. C 46,6 gam. D 18,64 gam.
Câu 45: Có các dung dịch NaCl, FeCl3, MgCl2, AlCl3, CuCl2. Để phân biệt các dung dịch trên người ta dùng dung dịch
A AgNO3 B H2SO4 loãng C NaOH D BaCl2
Câu 46: Cho Ba vào dung dịch có chứa ion NH4+, K+, CO32-, SO42-. Số phản ứng xảy ra tối đa là
A 5. B 3. C 4. D 2.
Câu 47: Để nhận biết ion Fe2+ trong dung dịch ta dùng dung dịch
A NaCl. B KOH. C K2SO4. D NaNO3.
Câu 48: Để tác dụng hết với 6,14gam hỗn hợp FeO , Fe2O3, Fe3O4 cần dùng vừa đủ 160ml dung dịch HCl 1M. Nếu khử hoàn toàn 6,14 gam hỗn hợp trên bằng khí CO ở nhiệt độ cao thì khối lượng Fe thu được là:
A 3,63 gam B 4,86 gam C 4,36 gam D 4,63 gam
1. C 2. B 3. A 4. A 5. A 6. C 7. B 8. D 9. C 10. B 11. A 12. C 13. A 14. D 15. D 16. C 17. B 18. D 19. D 20. B 21. A 22. B 23. C 24. D 25. B 26. A 27. C 28. C 29. D 30. A 31. B 32. D 33. B 34. A 35. C 36. A 37. B 38. D 39. D 40. D 41. A 42. A 43. D 44. C 45. C 46. C 47. B 48. B
Cho nguyên tử khối của các nguyên tố: H: 1; Li: 7; C: 12; N: 14; O: 16; Na: 23;Mg: 24;Al: 27; S: 32; Cl: 35,5; K: 39; Ca:40; Cr: 52; Fe: 56; Cu: 64; Zn: 65;Br: 80; Ba: 137; Ag: 108;Cs: 133
Câu 1: Cho hỗn hợp gồm 8,4 gam sắt và 3,6 gam Mg tác dụng với dung dịch H2SO4 loãng dư, thể tích khí (ở đktc) thu được sau phản ứng là
A. 6,72 lít. B. 10,08 lít. C. 8,96 lít. D. 8,4 lít.
Câu 2: Điện phân dung dịch CuSO4 nồng độ 0,5M với điện cực trơ trong thì thu được 1gam Cu. Nếu dùng dòng điện một chiều có cường độ 1A, thì thời gian điện phân tối thiểu có giá trị gần nhất là
A. 40 phút 45 giây. B. 40 phút 15 giây. C. 50 phút 15 giây. D. 50 phút 45 giây.
Câu 3: Cho 25 gam hỗn hợp bột gồm 5 oxit kim loại ZnO, FeO, Fe3O4, MgO, Fe2O3 tác dụng vừa đủ với 200 ml dung dịch HCl 2M. Kết thúc phản ứng, khối lượng muối có trong dung dịch X là
A. 36,0 gam. B. 39,6 gam. C. 38,0 gam. D. 39,2 gam.
Câu 4: Tiến hành bốn thí nghiệm sau:
- Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3;
- Thí nghiệm 2: Nhúng thanh Fe vào dung dịch CuSO4;
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3;
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl.
Số trường hợp xuất hiện ăn mòn điện hoá là
A. 1. B. 4. C. 2. D. 3.
Câu 5: Cho các chất: Al, AlCl3, Al2O3, Al(OH)3. Số chất có tính lưỡng tính là
A. 3. B. 2. C. 4. D. 1.
Câu 6: Có các kim loại Cu, Ag, Fe, Al, Au. Độ dẫn điện của chúng giảm dần theo thứ tự
A. Ag, Cu, Au, Al, Fe. B. Au, Ag, Cu, Al, Fe.
C. Ag, Au, Cu, Fe, Al. D. Ag, Cu, Fe, Al, Au.
Câu 7: Hiện tượng nào dưới đây được mô tả không đúng?
A. Cho bột Cu vào dung dịch FeCl3 màu vàng nâu, màu của dung dịch chuyển dần sang màu xanh.
B. Thêm NaOH vào dung dịch FeCl3 màu vàng nâu thấy xuất hiện kết tủa trắng xanh.
C. Cho bột sắt vào dung dịch FeCl3 thấy màu vàng nâu của dung dịch bị nhạt dần.
D. Cho CO2 đến vào dung dịch Ca(OH)2 thấy có kết tủa sau đó tan khi CO2 dư.
Câu 8: Dãy các ion xếp theo chiều giảm dần tính oxi hoá là
A. Ag+, Cu2+, Fe3+, Fe2+. B. Fe3+, Cu2+, Ag+, Fe2+.
C. Ag+, Fe3+, Cu2+, Fe2+. D. Fe3+, Ag+, Cu2+, Fe2+.
Câu 9: Sắt (Fe) ở ô số 26 của bảng tuần hoàn các nguyên tố hóa học. Cấu hình electron của ion Fe2+ là
A. [Ar] 3d54s1. B. [Ar]3d6. C. [Ar]3d64s2. D. [Ar] 3d44s2.
Câu 10: Cho các chất và ion sau: Fe; FeSO4; FeO; Fe3O4; Fe(NO3)3; FeCl2; Fe2+; Fe3+. Số lượng chất và ion có khả năng vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là
A. 5. B. 4. C. 6. D. 3.
Câu 11: Nhiệt phân hoàn toàn 40g một loại quặng đôlômit có lẫn tạp chất trơ, sinh ra 8,96 lít CO2 (đktc). Thành phần % về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là
A. 84%. B. 92%. C. 50%. D. 40%.
Câu 12: Cho các kim loại: Au, Al, Cu, Ag, Zn. Số kim loại tác dụng được với dung dịch H2SO4 loãng là
A. 5. B. 2. C. 4. D. 3.
Câu 13: Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M; lượng kết tủa thu được là 15,6g. Giá trị lớn nhất của V là
A. 2,4. B. 2,0. C. 1,2. D. 1,8.
Câu 14: Hồng ngọc (Ruby), là một loại đá quý thuộc về loại khoáng chất corundum. Chỉ có những corundum màu đỏ mới được gọi là hồng ngọc, các loại corundum khác được gọi là Sa-phia. Chất cấu tạo nên Sa-phia, hồng ngọc có công thức phân tử là
A. Fe2O3. B. Cr2O3. C. Al2O3. D. C (cacbon).
Câu 15: Nước cứng gây ra nhiều tác hại trong đời sống cũng như trong sản xuất. Một mẫu nước cứng chứa các ion: Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất được dùng để làm mềm mẫu nước cứng trên là
A. NaOH. B. Na2CO3. C. Ca(OH)2. D. HCl.
Câu 16: Nhận xét nào sau đây sai?
A. Nguyên tắc điều chế kim loại là oxi hóa ion kim loại thành nguyên tử kim loại.
B. Những tính chất vật lí chung của kim loại chủ yếu do các electron tự do trong mạng tinh thể kim loại gây ra.
C. Nguyên tử của hầu hết các nguyên tố kim loại có ít electron ở lớp ngoài cùng.
D. Tính chất hóa học chung của kim loại là tính khử.
Câu 17: Cho mạt sắt dư vào dung dịch X. Khi phản ứng kết thúc thấy khối lượng chất rắn giảm so với ban đầu. Dung dịch X có thể là
A. dung dịch FeCl3. B. dung dịch NiSO4.
C. dung dịch AgNO3. D. dung dịch CuSO4.
Câu 18: Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng (dư), thu được dung dịch X. Trong các chất: NaOH, Cu, Fe(NO3)3, KMnO4, BaCl2, Cl2 và Al, số chất có khả năng phản ứng được với dung dịch X là
A. 4. B. 7. C. 5. D. 6.
Câu 19: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 49,09. B. 35,50. C. 38,72. D. 34,36.
Câu 20: Chọn phương trình hóa học sai
A. CuO + 2HCl → CuCl2 + H2O. B. Na2CO3 + CaCl2 → CaCO3 + 2NaCl.
C. NaHCO3 + NaOH → Na2CO3 + H2O. D. 2Fe + 6HCl → 2FeCl3 + 3H2.
Câu 21: Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3. Hiện tượng xảy ra là
A. Xuất hiện kết tủa trắng, kết tủa không tan khi Ba(OH)2 dư.
B. Lúc đầu không xuất hiện kết tủa, sau đó có kết tủa trắng xuất hiện khi Ba(OH)2 dư.
C. Xuất hiện kết tủa trắng, sau đó tan một phần khi Ba(OH)2 dư.
D. Xuất hiện kết tủa trắng, sau đó tan hết khi Ba(OH)2 dư.
Câu 22: Hòa tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 vừa đủ, thu được dung dịch X (chỉ chứa 2 muối sunfat) và V lít (đktc) khí duy nhất NO. Giá trị của a và V lần lượt là
A. 0,04 mol và 8,96 lít. B. 0,12 mol và 17,92 lít.
C. 0,06 mol và 17,92 lít. D. 0,075mol và 8,96 lít.
Câu 23: Hợp chất được dùng để đúc tượng, bó bột khi gãy xương là
A. Vôi tôi. B. Thạch cao sống. C. Thạch cao nung. D. Vôi sống.
Câu 24: Tiến hành thí nghiệm như hình vẽ:
Nếu cho dung dịch NaOH đến dư thì số ống nghiệm thu được kết tủa khi phản ứng hoàn toàn là
A. 3. B. 1. C. 4. D. 2.
Câu 25: Công thức oxit của kim loại kiềm có dạng
A. RO. B. R2O3. C. R2O. D. RO2.
Câu 26: Hòa tan hết 34,8g FexOy bằng dung dịch HNO3 loãng, thu được dung dịch A. Cho dung dịch NaOH dư vào dung dịch A. Kết tủa thu được đem nung ở nhiệt độ cao cho đến khối lượng không đổi. Dùng H2 để khử hết lượng oxit tạo thành sau khi nung thu được 25,2g chất rắn. FexOy là
A. Fe2O3. B. Fe3O4. C. FeO. D. FeO hoặc Fe2O3.
Câu 27: Hòa tan một lượng gồm hai kim loại kiềm vào nước thu được 100 ml dung dịch A và 112 ml khí H2 (đktc). Giá trị pH của dung dịch A là
A. 1. B. 2. C. 12. D. 13.
Câu 28: Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dung dịch X và 8,736 lít khí H2(ở đktc). Cô cạn dung dịch X thu được lượng muối khan là
A. 29.55 gam. B. 38,93 gam. C. 25,95 gam. D. 77,96 gam.
Câu 29: Kim loại nhôm tan được trong
A. dung dịch HNO3 đặc, nguội. B. dung dịch NaCl.
C. dung dịch NaOH. D. Nước.
Câu 30: Cho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Tổng nồng độ phần trăm khối lượng của các chất tan trong dung dịch sau phản ứng là
A. 51,08%. B. 55,45%. C. 45,11%. D. 42,17%.
Câu 1: Cho các phát biểu sau:
(a) NaHCO3 được dùng làm thuốc chữa đau dạ dày do thừa axit.
(b) Ở nhiệt độ thường, tất cả các kim loại kiềm đều tác dụng được với nước.
(c) Công thức hóa học của thạch cao nung là CaSO4.H2O.
(d) Al(OH)3, NaHCO3, Al2O3 là các chất có tính chất lưỡng tính.
(e) Có thể dùng dung dịch NaOH để làm mềm nước cứng tạm thời.
Số phát biểu đúng là
A. 2. B. 4. C. 3. D. 5.
Câu 2: Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là :
A. vôi sống. B. Muối ăn. C. Cát. D. Lưu huỳnh.
Câu 3: Hỗn hợp A gồm 0,56g Fe và 16g Fe2O3, m (mol) Al rồi nung ở nhiệt độ cao không có không khí được hỗn hợp D. Nếu cho D tan trong H2SO4 loãng được V(lít) khí nhưng nếu cho D tác dụng với NaOH dư thì thu được 0,25V lít khí. Gía trị gần nhất của m là?
A. 0,12. B. 0,1233. C. 0,2467. D. 0,3699
Câu 4: Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là
A. 4,99%. B. 4,00%. C. 5,00%. D. 6,00%.
Câu 5: Sục từ từ CO2 vào V lít dung dịch Ca(OH)2 0,5M. Kết quả thí nghiệm biểu diễn trên đồ thị sau:
Giá trị của V là
A. 0,10. B. 0,05. C. 0,20. D. 0,80.
Câu 6: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác, trong đó hàm lượng cacbon chiếm
A. từ 2% đến 5%. B. từ 0,01% - 2%. C. trên 5%. D. từ 2% - 3%.
Câu 7: Dẫn một luồng hơi nước qua than nóng đỏ thì thu được V lít (ở đktc) hỗn hợp khí X gồm CO2, CO, H2, tỉ khối hơi của X so với H2 là 7,8. Toàn bộ V lít hợp khí X trên khử vừa đủ 24 gam hỗn hợp CuO, Fe2O3 nung nóng thu được rắn Y chỉ có 2 kim loại. Ngâm toàn bộ Y vào dung dịch HCl dư thấy có 4,48 lít H2 bay ra (ở đktc). Giá trị V là
A. 11,20 lít. B. 10,08 lít. C. 8,96 lít. D. 13,44 lít.
Câu 8: Cho thứ tự bốn cặp oxi-hóa khử trong dãy điện hóa như sau: Na+/Na; Mg2+/Mg; Al3+/Al; Ag+/Ag. Kim loại nào có tính khử mạnh nhất trong các kim loại sau?
A. Ag. B. Al. C. Na. D. Mg.
Câu 9: Al2O3 phản ứng được với cả hai dung dịch
A. NaCl, H2SO4. B. NaOH, HCl. C. KCl, NaNO3. D. Na2SO4, KOH.
Câu 10: Quặng hematit nâu có chứa
A. Fe2O3 khan. B. Fe3O4. C. FeCO3. D. Fe2O3.nH2O.
Câu 11: Hòa tan hết m gam hỗn hợp gồm Al, Zn, Mg cần 2,08 mol HNO3 thu được 0,1 mol N2O; x mol N2. Cô cạn dung dịch được 132 gam muối khan. Giá trị của x, m lần lượt là (không có sản phẩm khử khác của N+5).
A. 0,128; 3,04. B. 0,090; 26,60. C. 0,128; 26,60. D. 0,090; 3,04.
Câu 12: Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm thổ là
A. ns2np2. B. ns2np1. C. ns2. D. ns1.
Câu 13: Nước có chứa các ion : Ca2+, Mg2+, HCO3-, SO42- và Cl- gọi là
A. Nước có tính cứng vĩnh cữu. B. Nước có tính cứng tạm thời.
C. Nước có tính cứng toàn phần. D. Nước mềm.
Câu 14: Dung dịch HCl, H2SO4 loãng sẽ oxi hóa crom đến mức oxi hóa nào?
A. +4. B. +6. C. +2. D. +3.
Câu 15: Có bốn thanh sắt được đặt tiếp xúc với những kim loại khác nhau và nhúng trong các dung dịch HCl như hình vẽ dưới đây:
Thanh sắt bị hòa tan chậm nhất sẽ là thanh được đặt tiếp xúc với:
A. Ni. B. Zn. C. Cu. D. Sn.
Câu 16: Nung m gam Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được 7,2 gam một oxit. Giá trị của m là
A. 10,7. B. 21,4 C. 16. D. 9,63.
Câu 17: Nhận định nào sau đây đúng khi cho Ca vào dung dịch Na2CO3 ?
A. Ca tác dụng với nước, đồng thời dung dịch đục do Ca(OH)2 ít tan.
B. Ca khử Na+ thành Na, dung dịch xuất hiện kết tủa trắng CaCO3.
C. Ca tan trong nước sủi bọt khí H2, dung dịch xuất hiện kết tủa trắng CaCO3.
D. Ca khử Na+ thành Na, Na tác dụng với nước tạo H2 bay hơi, dung dịch xuất hiện kết tủa trắng.
Câu 18: Kim loại nào sau đây có thể tác dụng với nước ở điều kiện thường tạo ra dung dịch làm xanh giấy quỳ tím là
A. Ba. B. Fe. C. Zn. D. Be.
Câu 19: Cho phương trình hóa học phản ứng oxi hóa hợp chất Fe(II) bằng oxi không khí:
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
Kết luận nào sau đây là đúng?
A. O2 là chất khử, H2O là chất oxi hoá.
B. Fe(OH)2 là chất khử, H2O là chất oxi hoá.
C. Fe(OH)2 là chất khử, O2 và H2O là chất oxi hoá.
D. Fe(OH)2 là chất khử, O2 là chất oxi hoá.
Câu 20: Hoà tan hoàn toàn 33,1g hỗn hợp Mg, Fe, Zn vào trong dung dịch H2SO4 loãng dư thấy có 13,44 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
A. 90,7g B. 75,5g C. 78,7g D. 74,6g
Câu 21: Crom có số hiệu nguyên tử là 24. Cấu hình electron của ion Cr3+ là
A. [Ar]3d4. B. [Ar]3d2. C. [Ar]3d5. D. [Ar]3d3.
Câu 22: Cho sơ đồ sau:
Công thức của X, Y, Z lần lượt là:
A. HCl, HNO3, Na2NO3. B. Cl2, AgNO3, MgCO3.
C. Cl2, HNO3, CO2. D. HCl, AgNO3, (nh4)2CO3.
Câu 23: Phèn chua có công thức hóa học là M2SO4.Al2(SO4)3.24H2O. M là
A. NH4. B. Na. C. K. D. Li.
Câu 24: Cho luồng khí CO dư đi qua hỗn hợp X gồm: Al2O3, ZnO, Fe2O3, CuO nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y gồm
A. Al2O3, Zn, Fe, Cu. B. Al, Zn, Fe, Cu.
C. Al2O3, ZnO, Fe, Cu. D. Al2O3, ZnO, Fe2O3, Cu.
Câu 25: Tiến hành các thí nghiệm sau:
(1) Cho bột Fe vào dung dịch AgNO3.
(2) Cho Fe vào dung dịch Fe2(SO4)3 dư.
(3) Cho dung dịch FeCl2 vào dung dịch AgNO3 (dư).
(4) Dẫn khí CO (dư) qua bột Fe2O3 nung nóng.
Số thí nghiệm có tạo thành kim loại là
A. 1. B. 2. C. 4. D. 3.
Câu 26: Cho 350 ml dung dịch NaOH 2M vào 100 ml dung dịch AlCl3 2M, thu được kết tủa có khối lượng là:
A. 0,0 gam. B. 7,8 gam. C. 18,2 gam. D. 15,6 gam.
Câu 27: Cho 20 gam hỗn hợp X gồm Fe, FeO, Fe3O4, Fe2O3 tan vừa hết trong 700 ml dung dịch HCl 1M, thu được 3,36 lít H2 (đktc) và dung dịch Y. Cho dung dịch Y tác dụng với NaOH dư, lọc kết tủa và nung trong không khí đến khối lượng không đổi thu được chất rắn Y. Khối lượng Y là
A. 24 gam. B. 8 gam. C. 16 gam. D. 32 gam.
Câu 28: Điện phân với điện cực trơ dung dịch chứa 0,2 mol Cu(NO3)2, cường độ dòng điện 2,68A, trong thời gian t (giờ), thu được dung dịch X. Cho 14,4 gam bột Fe vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và 13,5 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn và hiệu suất của quá trình điện phân là 100%. Giá trị gần nhất của t là
A. 1,00. B. 1,20. C. 0,25. D. 0,60.
Câu 29: Cho bột Fe vào dung dịch AgNO3 dư, sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch gồm các chất tan:
A. Fe(NO3)2, AgNO3, Fe(NO3)3. B. Fe(NO3)2, AgNO3.
C. Fe(NO3)3, AgNO3. D. Fe(NO3)2, Fe(NO3)3.
Câu 30: Để sản xuất nhôm trong công nghiệp người ta
A. Điện phân Al2O3 nóng chảy có mặt criolit.
B. Điện phân dung dịch AlCl3.
C. Cho CO dư đi qua Al2O3 nung nóng.
D. Cho Mg vào dung dịch Al2(SO4)3.
Câu 1: Để thu được kim loại Cu từ dung dịch Cu(NO3)2 theo phương pháp thuỷ luyện, có thể dùng kim loại nào sau đây?
A. Zn. B. Ca. C. Na. D. Rb.
Câu 2: Nước cứng vĩnh cửu có chứa các ion
A. Mg2+; Na+; . B. K+; Na+; ; . C. Mg2+; Ca2+; . D. Mg2+; Ca2+; .
Câu 3: Dãy cation kim loại được sắp xếp theo chiều tăng dần tính oxi hóa từ trái sang phải là
A. Mg2+, Fe2+ , Cu2+. B. Cu2+, Fe2+, Mg2+ . C. Mg2+, Cu2+, Fe2+. D. Cu2+, Mg2+, Fe2+.
Câu 4: Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, Al2O3, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm
A. Cu, Fe, Al2O3, MgO. B. Cu, Fe, Al, MgO. C. Cu, FeO, Al2O3, MgO. D. Cu, Fe, Al, Mg.
Câu 5: Cho một thanh sắt nặng 20 gam vào 200ml dung dịch CuSO4 0,5M. Sau phản ứng, rửa sạch, sấy khô thanh sắt và đem cân lại có khối lượng là
A. 5,6 gam. B. 6,4 gam. C. 20,8 gam. D. 19,2 gam.
Câu 6: Cho một mẫu hợp kim Na-K-Ca tác dụng với nước (dư), thu được dung dịch X và 3,36 lít H2 (đktc). Thể tích dung dịch axit HCl 1,5M cần dùng để trung hoà một phần hai dung dịch X là
A. 75 ml. B. 150 ml. C. 100 ml. D. 50 ml.
Câu 7: Tiến hành các thí nghiệm sau
(1) Ngâm lá đồng trong dung dịch AgNO3; (2) Ngâm lá kẽm trong dung dịch HCl loãng;
(3) Ngâm lá sắt được cuốn dây đồng trong dung dịch HCl;
(4) Để một vật bằng gang ngoài không khí ẩm; (5) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3.
Số thí nghiệm xảy ra ăn mòn hóa học là
A. 3. B. 1. C. 2. D. 4.
Câu 8: Điện phân 500 ml dung dịch AgNO3 với điện cực trơ cho đến khi catot bắt đầu có khí thoát ra thì ngừng lại. Để trung hòa dung dịch sau điện phân cần 800 ml dung dịch NaOH 1M. Nồng độ mol AgNO3 và thời gian điện phân là bao nhiêu (biết I = 20A)?
A. 1,6M, 360 giây. B. 0,4M, 380 giây. C. 0,8M, 3860 giây. D. 1,6M, 3860 giây.
Câu 9: Dụng cụ không dùng để đựng dung dịch nước vôi trong là
A. cốc sắt. B. cốc thủy tinh. C. cốc nhôm. D. cốc nhựa.
Câu 10: Nung 24gam một hỗn hợp Fe2O3 và CuO trong một luồng khí H2 dư. Phản ứng hoàn toàn. Cho hỗn hợp khí tạo ra trong phản ứng đi qua bình đựng H2SO4 đặc thấy khối lượng của bình này tăng lên 7,2 gam. Vậy khối lượng Fe và Cu thu được sau phản ứng là:
A. 11,2g Fe; 3,2g Cu B. 11,2g Fe; 6,4g Cu C. 5,6g Fe; 3,2g Cu D. 5,6g Fe; 6,4g Cu
Câu 11: Cho 19,6 gam hỗn hợp gồm K, Al, Zn tác dụng với dung dịch H2SO4 loãng, dư, thu được 11,2 lít H2 (đktc). Cô cạn dung dịch thu được muối khan có khối lượng bằng:
A. 67,6 gam. B. 68,6 gam. C. 43,6 gam. D. 28,4 gam.
Câu 12: Chất phản ứng vừa phản ứng được với dung dịch NaOH, vừa phản ứng với dung dịch HCl là
A. CuO. B. Al2O3. C. KOH. D. MgO.
Câu 13: Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p1. Số hiệu nguyên tử của X là
A. 14. B. 15. C. 27. D. 13.
Câu 14: Ở nhiệt độ thường, kim loại Na phản ứng với nước tạo thành
A. Na2O và H2. B. NaOH và H2. C. NaOH và O2. D. Na2O và O2.
Câu 15: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có hiện tượng
A. kết tủa trắng xuất hiện. B. không có hiện tượng.
C. kết tủa trắng, sau đó kết tủa tan dần. D. bọt khí và kết tủa trắng.
Câu 16: Hòa tan hoàn toàn 2,8 gam hỗn hợp FeO, Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M, thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 3 gam chất rắn. Tính V ?
A. 125 B. 175 C. 62,5 D. 87,5
Câu 17: Cặp kim loại nào sau đây đều không tác dụng với dung dịch axit H2SO4 loãng?
A. Mg, K. B. Ag, Cu. C. Fe, Cu. D. Na, Ag
Câu 18: Cho hỗn hợp rắn A gồm 5,6 gam Fe và 6,4 gam Cu tác dụng với 300 ml dung dịch AgNO3 2M khi phản ứng hoàn toàn khối lượng chất rắn thu được là
A. 64,8 gam. B. 21,6 gam. C. 54,0 gam. D. 43,2 gam.
Câu 19: Hợp chất sắt(II) hiđroxit có màu gì?
A. Màu vàng. B. Màu trắng hơi xanh. C. Màu đen. D. Màu trắng.
Câu 20: Nung hỗn hợp X gồm Al, Fe2O3 được hỗn hợp Y (hiệu suất 100%). Hòa tan hết Y bằng HCl dư được 2,24 lít khí (đktc), cũng lượng Y này nếu cho phản ứng với dung dịch NaOH dư thấy còn 8,8g rắn Z. Khối lượng các chất trong X là?
A. mAl=5,4g, mFe2O3=1,12g B. mAl=5,4g, mFe2O3=11,2g
C. mAl=2,7g, mFe2O3=11,2g D. mAl=2,7g, mFe2O3=1,12g
Câu 21: Hòa tan hoàn toàn 1,6 gam Cu bằng dung dịch HNO3, thu được x mol NO2 (là sản phẩm khử duy nhất của N+5). Giá trị của x là
A. 0,15. B. 0,25. C. 0,10. D. 0,05.
Câu 22: Một loại nước cứng có chứa các ion: Ca2+, Mg2+, Cl- và SO42-. Hóa chất nào trong số các chất sau đây có thể làm mềm loại nước cứng trên?
A. K2CO3. B. KNO3. C. NaOH. D. NaCl.
Câu 23: Cho các hợp kim sau: Al – Zn (1); Fe – Zn (2); Zn – Cu (3); Mg – Zn (4). Khi tiếp xúc với dung dịch axit H2SO4 loãng thì các hợp kim mà trong đó Zn bị ăn mòn điện hóa học là
A. (2), (3) và (4). B. (2) và (3). C. (1), (2) và (3). D. (3) và (4).
Câu 24: Kim loại nào sau đây có tính khử mạnh nhất trong số các kim loại Fe, K, Al, Na
A. Al. B. Na. C. Fe. D. K.
Câu 25: Hấp thụ hết 0,3 mol khí CO2 vào 2 lít dung dịch hỗn hợp Ba(OH)2 0,025M và NaOH 0,15M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là:
A. 39,40 B. 39,80 C. 19,70 D. 9,85
Câu 26: Kim loại dẫn điện tốt nhất là
A. Cu. B. Ag. C. Au. D. Al.
Câu 27: Sục từ từ khí CO2 vào dung dịch natri aluminat đến dư thì
A. tạo kết tủa Al(OH)3, phần dung dịch chứa NaHCO3.
B. tạo kết tủa Al(OH)3, phần dung dịch chứa Na2CO3.
C. không có phản ứng xảy ra. D. tạo kết tủa Al(OH)3, sau đó kết tủa bị hòa tan lại.
Câu 28: Cho phương trình hóa học phản ứng oxi hóa hợp chất Fe(II) bằng oxi không khí:
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
Kết luận nào sau đây là đúng?
A. Fe(OH)2 là chất khử, O2 và H2O là chất oxi hoá. B. Fe(OH)2 là chất khử, H2O là chất oxi hoá.
C. O2 là chất khử, H2O là chất oxi hoá. D. Fe(OH)2 là chất khử, O2 là chất oxi hoá.
Câu 29: Phát biểu nào sau đây là sai?
A. Thạch cao nung (CaSO4.2H2O) được dùng để bó bột, đúc tượng.
B. Na2CO3 là nguyên liệu quan trọng trong công nghiệp sản xuất thủy tinh.
C. Thành phần chính của quặng đolomit là CaCO3.MgCO3.
D. Các kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa.
Câu 30: Cho các kim loại sau: Li, Na, Al, Ca. Số kim loại kiềm thổ trong dãy là
A. 1. B. 2. C. 3. D. 4.
XEM THÊM:
YOPOVN xin gửi đến quý thầy cô, các em học sinh DANH SÁCH Đề thi thử hóa học kì 2 lớp 12 CÓ ĐÁP ÁN NĂM 2022 MỚI NHẤT. Đây là bộ Đề thi thử hóa học kì 2 lớp 12.
Tìm kiếm có liên quan
De thi học kì 2 lớp 12 môn Hóa trắc nghiệm có đáp an
Đề thi Hóa 12 học kì 2
Đề thi học kì 2 môn Hóa lớp 12 có đáp an Đồng Nai
Hóa 12 học kì 2 tử bài nào
Đề thi Hóa học kì 2 lớp 12 Quảng Nam
Hóa học kì 2 lớp 12 tử Bài nào
Đề Minh Hóa học kì 2 lớp 12
De thi Hóa 12 có đáp an
De thi giữa học kì 2 lớp 12 môn Hóa trắc nghiệm có đáp an
De thi Hóa HK2 lớp 12 có đáp an
Hóa 12 học kì 2 tử bài nào
Lý thuyết Hóa 12 học kì 2
De thi học kì 1 Hóa 12 có lời giải
De thi Hóa 12 có đáp an
Hóa học kì 2 lớp 12 tử Bài nào
Đề thi học kì 2 môn Hóa lớp 12 có đáp an Đồng Nai
ĐỀ 1 |
A. PHẦN DÙNG CHUNG CHO TẤT CẢ HỌC SINH: (20 câu)
Câu 1: Chất X là một bazơ mạnh, được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất amoniac, clorua vôi, vật liệu xây dựng…. Công thức của X là
A. NaOH. B. KOH. C. Ca(OH)2. D. Ba(OH)2.
Câu 2: Nước cứng gây ra nhiều tác hại trong đời sống cũng như trong sản xuất. Để làm mềm một loại nước cứng có tính cứng toàn phần, ta có thể dùng
A. Ca(OH)2. B. NaOH. C. HCl. D. Na2CO3.
Câu 3: Cho các kim loại: Ca, Fe, Cu, Ag, Cr, Zn. Số kim loại tác dụng được với dung dịch HCl là
A. 2. B. 3. C. 5. D. 4.
Câu 4: Phèn chua là một chất có nhiều ứng dụng quan trọng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước…. Công thức hóa học của phèn chua là
A. K2SO4.Al2(SO4)3.24H2O. B. (NH4)2SO4.Al2(SO4)3.24H2O.
C. Na2SO4.Al2(SO4)3.24H2O. D. Li2SO4.Al2(SO4)3.24H2O.
Câu 5: Sục từ từ cho đến dư khí CO2 vào dung dịch Ca(OH)2. Hiện tượng hóa học xảy ra là
A. Xuất hiện kết tủa trắng sau đó tan khi CO2 dư.
B. Xuất hiện kết tủa màu trắng xanh, sau đó chuyển sang nâu đỏ.
C. Xuất hiện kết tủa trắng không tan khi CO2 dư.
D. Không hiện tượng do không có phản ứng xảy ra.
Câu 6: Trong số các cation kim loại: Fe2+, Fe3+, Cu2+, Ag+. Ion có tính oxi hóa mạnh nhất là
A. Fe2+. B. Cu2+. C. Fe3+. D. Ag+.
Câu 7: Nhiệt phân hoàn toàn 16,2 gam Ca(HCO3)2 thu được chất rắn có khối lượng là
A. 5,6 gam. B. 5 gam. C. 11,2 gam. D. 10 gam.
Câu 8: Cho 8,4 gam sắt tác dụng với dung dịch HNO3 đặc nóng dư, thể tích khí NO2 (sản phẩm khử duy nhất, ở đktc) thu được sau phản ứng là
A. 3,36 lít. B. 10,08 lít. C. 5,04 lít. D. 6,72 lít.
Câu 9: Cấu hình electron lớp ngoài cùng của các kim loại kiềm có dạng
A. ns2np1. B. ns1. C. ns2np5. D. ns2.
Câu 10: Kim loại cứng nhất là
A. Cr. B. W. C. Ag. D. Fe.
Câu 11: Hiện tượng nào dưới đây được mô tả không đúng?
A. Thêm Fe(OH)3 màu đỏ nâu vào dung dịch H2SO4 thấy hình thành dung dịch có màu vàng nâu.
B. Thêm NaOH vào dung dịch FeCl3 màu vàng nâu thấy xuất hiện kết tủa đỏ nâu.
C. Thêm một ít bột Fe vào dung dịch AgNO3 dư thấy xuất hiện dung dịch có màu xanh nhạt.
D. Thêm Cu vào dung dịch Fe(NO3)3 thấy dung dịch chuyển từ màu vàng nâu sang màu xanh lam.
Câu 12: Cho các hợp kim: Fe–Cu; Fe–C; Zn–Fe; Mg–Fe tiếp xúc với không khí ẩm. Số hợp kim trong đó Fe bị ăn mòn điện hóa là
A. 1. B. 3. C. 4. D. 2.
Câu 13: Trong phòng thí nghiệm, để xử lí sơ bộ một số chất thải ở dạng dung dịch chứa ion Fe3+ và Cu2+ ta có thể dùng lượng dư
A. dung dịch muối ăn. B. nước vôi trong.
C. ancol etylic. D. giấm ăn.
Câu 14: Điện phân nóng chảy 14,9 gam muối clorua của kim loại M thu được 2,24 lít khí Cl2 (ở đktc). Công thức của muối clo rua đã điện phân là
A. NaCl. B. CaCl2. C. KCl. D. MgCl2.
Câu 15: Sắt (Fe) ở ô số 26 của bảng tuần hoàn các nguyên tố hóa học. Cấu hình electron của ion Fe2+ là
A. [Ar]3d64s2. B. [Ar]3d6. C. [Ar] 3d44s2. D. [Ar] 3d54s1.
Câu 16: Tiến hành 3 thí nghiệm như hình vẽ sau (chất lỏng trong các cốc đều là dung dịch H2SO4 loãng với nồng độ bằng nhau):
| | ||||
| |||||
Cốc (1) Cốc (2) Cốc (3)
Nhận định đúng về các thí nghiệm trên là
A. Cốc (3) không xảy ra ăn mòn điện hóa học.
B. Cả ba cốc sắt đều bị ăn mòn.
C. Cốc (3) sắt không bị ăn mòn.
D. Tốc độ ăn mòn sắt ở cốc (1) nhanh hơn cốc (2).
Câu 17: Kim loại nhôm không phản ứng với
A. dung dịch H2SO4 loãng, nguội. B. dung dịch NaOH.
C. dung dịch HCl. D. dung dịch H2SO4 đặc, nguội.
Câu 18: Cho m gam hỗn hợp nhôm và magiê tác dụng với dung dịch HCl dư thu được 10,08 lít khí H2 (đktc). Nếu cho m gam hỗn hợp trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít khí (đktc). Giá trị của m là
A. 9,0 gam. B. 10,2 gam. C. 7,8 gam. D. 7,5 gam.
Câu 19: Cho các chất: Al, AlCl3, Al2O3, Al(OH)3. Số chất vừa tác dụng với dụng dịch HCl, vừa tác dụng với dung dịch NaOH là
A. 1. B. 3. C. 2. D. 4.
Câu 20: Nhận xét nào sau đây sai?
A. Những tính chất vật lí chung của kim loại chủ yếu do các electron tự do trong mạng tinh thể kim loại gây ra.
B. Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử.
C. Tính chất hóa học chung của kim loại là tính oxi hóa.
D. Nguyên tử của hầu hết các nguyên tố kim loại đều có ít electron ở lớp ngoài cùng.
B. PHẦN RIÊNG: (10 câu)
I. DÀNH RIÊNG CHO HỌC SINH KHOA HỌC XÃ HỘI:
Câu 21: Cho các chất và ion sau: Fe; FeSO4; Fe2(SO4)3; FeCl2; Fe2+; Fe3+. Số lượng chất và ion có khả năng đóng vai trò chất khử là
A. 3. B. 2. C. 5. D. 4.
Câu 22: Cho 7,8 gam hỗn hợp gồm Al, Mg tác dụng với dung dịch HCl dư rồi cô cạn cẩn thận dung dịch sau phản ứng thì thu được 36,2 gam hỗn hợp muối khan. Thể tích khí H2 thu được (ở đktc) là
A. 6,72 lít. B. 8,96 lít. C. 4,48 lít. D. 7,84 lít.
Câu 23: Cho m gam Cu tác dụng với dung dịch HNO3 loãng dư. Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí NO (sản phẩm khử duy nhất ở đktc) và dung dịch X. Khối lượng muối khan thu được khi cô cạn dung dịch X là
A. 37,6 gam. B. 28,2 gam. C. 9,6 gam. D. 18,8 gam.
Câu 24: Chọn phát biểu sai
A. Tất cả kim loại kiềm thổ đều có hai electron ở lớp ngoài cùng.
B. Điều chế kim loại kiềm thổ bằng phương pháp điện phân nóng chảy.
C. Kim loại kiềm thổ có tính khử mạnh, chỉ kém kim loại kiềm.
D. Hiđroxit của tất cả kim loại kiềm thổ đều tan tốt trong nước.
Câu 25: Dẫn 3,36 lít khí CO2 (ở đktc) vào 300 mililit dung dịch NaOH 0,5M thu được dung dịch X. Cô cạn cẩn thận dung dịch X thu được khối lượng muối khan là
A. 12,6 gam. B. 15,9 gam. C. 8,4 gam. D. 7,95 gam.
Câu 26: Kim loại có thể khử Cu2+ trong dung dịch CuSO4 thành Cu đơn chất là
A. Ag. B. K. C. Zn. D. Ca.
Câu 27: Khử hoàn toàn 11,52 gam oxit sắt cần vừa đủ 4,8384 lít khí CO (đktc). Oxit sắt đã dùng là
A. FeO. B. Fe2O3 hoặc FeO. C. Fe2O3. D. Fe3O4.
Câu 28: Nhóm các kim loại có thể điều chế bằng phương pháp nhiệt luyện là
A. Fe, Cu, Ag. B. K, Al, Cu. C. Li, Cu, Ag. D. Al, Fe, Cu.
Câu 29: Cho từ từ dung dịch NaOH vào 500 mililit dung dịch hỗn hợp Al2(SO4)3 0,2M và FeCl3 0,2 M, khối lượng kết tủa thu được lớn nhất là
A. 15,6 gam. B. 26,3 gam. C. 18,5 gam. D. 10,7 gam.
Câu 30: Chọn phương trình hóa học sai
A. 2Fe + 6HCl à 2FeCl3 + 3H2.
B. NaHCO3 + Ca(OH)2 à CaCO3 + NaOH + H2O.
C. 2NaOH + 2Al + 2H2O à 2NaAlO2 + 3H2.
D. Zn + 4HCl à ZnCl2 + H2O.
II. DÀNH RIÊNG CHO HỌC SINH KHOA HỌC TỰ NHIÊN:
Câu 31: Chọn phương trình hóa học sai
A. NaHCO3 + NaOH à Na2CO3 + H2O.
B. Na2CO3 + Ca(HCO3)2 à CaCO3 + 2NaHCO3.
C. NaOH + Ca(HCO3)2 à NaOH + CaCO3 + H2O.
D. 2Na + H2O à Na2O + H2.
Câu 32: Khử hoàn toàn m gam oxit MxOy cần vừa đủ 17,92 lít khí CO (đktc), thu được a gam kim loại M. Hòa tan hết a gam M bằng dd H2SO4 đặc, nóng, dư, thu được 20,16 lít khí SO2 (sản phẩm khử duy nhất ở đktc). Oxit kim loại đã dùng là
A. CuO. B. Fe2O3. C. Cr2O3. D. Fe3O4.
Câu 33: Cho các thí nghiệm sau đây:
Cho dung dịch NaOH đến dư vào dung dịch Mg(NO3)2.
Cho dung dịch NH3 đến dư vào dung dịch AlCl3.
Cho dung dịch HCl đến dư vào dung dịch NaAlO2.
Thổi CO2 đến dư vào dung dịch Ca(OH)2.
Cho bột Mg vào dung dịch FeCl3 dư.
Số thí nghiệm thu được kết tủa sau phản ứng là
A. 2. B. 4. C. 3. D. 1.
Câu 34: Cho các chất và ion sau: Fe; FeSO4; Fe2(SO4)3; FeCl2; Fe2+; Fe3+. Số lượng chất và ion có khả năng vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là
A. 2. B. 4. C. 5. D. 3.
Câu 35: Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hỗn hợp gồm x mol AlCl3 và y mol FeCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Tỉ lệ x:y là
A. 2:3. B. 2:1. C. 1:1. D. 3:1.
Câu 36: Cho 2,16 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,896 lít khí NO (ở đktc) và dung dịch X. Khối lượng muối khan thu được khi cô cạn dung dịch X là
A. 13,32 gam. B. 13,92 gam. C. 9,6 gam. D. 18,12 gam.
Câu 37: Hỗn hợp X gồm Fe(NO3)2, Cu(NO3)2 và AgNO3. Thành phần % khối lượng của nitơ trong X là 11,864%. Từ 70,8 gam X có thể điều chế tối đa m gam hỗn hợp kim loại. Giá trị của m là
A. 16,8 gam. B. 52,8 gam. C. 33,6 gam. D. 38,4 gam.
Câu 38: Cho 24,12 gam hỗn hợp X gồm CuO , Fe2O3 , Al2O3 tác dụng vừa đủ với 350ml dd HNO3 4M rồi cô cạn cẩn thận dung dịch sau phản ứng thì thu được m gam hỗn hợp muối khan. Giá trị của m là
A. 99,72 gam. B. 86,80 gam. C. 110,92 gam. D. 77,92 gam.
Câu 39: Dẫn 1,288 lít khí CO2 (ở đktc) vào 400 mililit dung dịch hỗn hợp Ca(OH)2 0,05M và NaOH 0,075M thấy có m gam kết tủa. Giá trị của m là
A. 1,25 gam. B. 1,75 gam. C. 2 gam. D. 5,75 gam.
Câu 40: Cho m gam kim loại Na vào 200 mililit dung dịch HCl 1M, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được 35,1 gam chất rắn khan. Giá trị gần nhất của m là
A. 24 gam. B. 18 gam. C. 14 gam. D. 28 gam.
-------HẾT-------
ĐÁP ÁN
ĐÁP ÁN
1 | C | 11 | C | 21 | D | 31 | D |
2 | D | 12 | D | 22 | B | 32 | D |
3 | D | 13 | B | 23 | B | 33 | A |
4 | A | 14 | C | 24 | D | 34 | D |
5 | A | 15 | B | 25 | A | 35 | B |
6 | D | 16 | C | 26 | C | 36 | B |
7 | A | 17 | D | 27 | C | 37 | C |
8 | B | 18 | A | 28 | A | 38 | A |
9 | B | 19 | B | 29 | B | 39 | A |
10 | A | 20 | C | 30 | A | 40 | B |
ĐỀ 2 |
Câu 1: Các chất đều tác dụng với dung dịch Ca(OH)2 gồm
A CO2, HNO3, NaNO3. B NaHCO3, CO2, CH3NH2 C NH4NO3, Ca(HCO3)2, Na2CO3. D CO2, NaCl, Na2CO3.
Câu 2: Có 4 dung dịch: Na2CO3, NaOH, NaCl, HCl. Nếu chỉ dùng thêm quỳ tím thì có thể nhận biết được
A 3dung dịch. B 4 dung dịch. C 1dung dịch. D 2 dung dịch.
Câu 3: Cho 14,4gam hỗn hợp Fe, Cu tác dụng với dung dịch HCl dư, sau phản ứng thu được 4,48 lít khí (đktc). Khối lượng của Cu trong hỗn hợp là
A 3,2 gam B 64,0 gam C 6,4 gam D 0,64 gam
Câu 4: Cho hỗn hợp CaO, MgO, Na2CO3, Fe3O4 tan vào nước ta thu được chất rắn gồm
A CaCO3, MgO, Fe3O4 B Na2CO3, Fe3O4. C MgO, Fe3O4. D CaO, MgO, Fe3O4.
Câu 5: Có 3 cốc nước : nước cất, nước cứng tạm thời (chứa Ca(HCO3)2), nước cứng vĩnh cửu (chứa CaSO4). Phương pháp nhận biết 3 cốc nước trên là
A đun nóng và dùng dung dịch Na2CO3. B đun nóng, sau đó dùng dung dịch nước vôi. C dùng quỳ tím, dùng dung dịch HCl. D dùng dung dịch HCl, sau đó đun nhẹ.
Câu 6: Cho hỗn hợp Al, Fe vào dung dịch chứa hỗn hợp Cu(NO3)2 và AgNO3, sau phản ứng thu được hỗn hợp rắn gồm 3 kim loại. Ba kim loại đó là
A Al, Fe, Ag B Al, Fe, Cu C Ag, Cu, Fe D Ag, Cu, Al
Câu 7: .Mô tả nào dưới đây không phù hợp với nhôm?
A mức oxi hóa đặc trưng trong hợp chất là +3 B nhôm ở ô thứ 13, chu kì 2, nhóm IIIA C tinh thể cấu tạo lập phương tâm diện D cấu hình e rút gọn: [Ne] 3s2 3p1
Câu 8: Dung dịch FeSO4 có lẫn CuSO4. Để loại bỏ tạp chất có thể dùng một lượng dư
A Al B Cu C Ag D Fe
Câu 9: Sục khí CO2 dư vào dung dịch muối X thu được kết tủa trắng. Nhỏ từ từ dung dịch HCl vào dung dịch muối X đặc dư, thấy xuất hiện kết tủa trắng sau đó kết tủa tan dần. Muối X là
A C6H5ONa B BaCl2 C NaAlO2 D AlCl3
Câu 10: Cho Na vào 300ml dung dịch AlCl3. Khi phản ứng kết thúc thu được 5,6 lít khí H2 (đktc), dung dịch A và kết tủa B. Lọc lấy kết tủa đem nung đến khối lượng không đổi thu được 5,1 gam chất rắn D. Nồng độ mol của dung dịch AlCl3 là
A 0,8 M B 0.5 M C 0,4 M D 0,6 M
Câu 11: Cho 6 gam kim loại kiềm thổ tác dụng hết với nước thu được 12,22 lít khí (ở 250C; 0,5atm). Kim loại kiềm thổ đã dùng là
A Mg B Sr C Ba D Ca
Câu 12: Phát biểu sai là: Fe có khả năng tan trong dung dịch
A FeCl3 B AgNO3 C FeCl2 D CuSO4
Câu 13: Phương trình hóa học viết sai là
A Fe + Cl2 FeCl2 B 3Fe + 2O2 Fe3O4 C Fe (dư) + 2AgNO3 Fe(NO3)2 + 2Ag D Fe + 2HCl FeCl2 + H2
Câu 14: Cho a mol NaAlO2 tác dụng với dung dịch có chứa b mol HCl. Điều kiện của a và b để xuất hiện kết tủa là
A b 4a B b> 4a C b = 4a D b < 4a
Câu 15: Cho 7.8gam kim loại kiềm M tác dụng với lượng nước (dư) sinh ra 2,24 lít H2 (đktc). Kim loại M là
A Ba B Na C Ca D K
Câu 16: Phản ứng giữa Al(OH)3 với dung dịch xút thuộc loại phản ứng
A phân hủy B oxi hóa - khử C axit - bazơ D thế
Câu 17: Để bảo quản dung dịch Fe2(SO4)3, tránh hiện tượng thủy phân người ta thường nhỏ vào ít giọt dung dịch
A NH3. B H2SO4. C BaCl2. D NaOH.
Câu 18: Cho sơ đồ chuyển hóaH2 (A)KAlO2(B)(C)(A). Các chất A, B, C lần lượt là
A K, Al(OH)3, Al2O3 B Al, KHCO3, Al2O3 C Al2O3, Al(OH)3, Al D Al, Al(OH)3, Al2O3
Câu 19: Cho 33.9 gam hỗn hợp bột nhôm oxit và nhôm tác dụng vừa đủ với 675 ml dung dịch HCl 4M. Khối lượng nhôm trong hỗn hợp ban đầu là
A 6,75 gam B 10,20 gam. C 11,85 gam. D 13,5gam
Câu 20: Dẫn 8,96 lít khí CO2 (đktc) vào 350 ml dung dịch Ca(OH)2 1M. Khối lượng kết tủa thu được là
A 15 gam. B 30 gam. C 20 gam. D 25 gam.
Câu 21: Cho phản ứng Fe + Cu2+ Fe2+ + Cu. Nhận xét không đúng là
A ion Fe2+ oxi hóa được kim loại Cu. B kim loại Fe khử được ion Cu2+ C tính oxi hóa của ion Fe2+ yếu hơn ion Cu2+ D kim loại Fe có tính khử mạnh hơn kim loại Cu.
Câu 22: Cho hỗn hợp kim loại gồm Na và Al vào nước, thu được dung dịch và 4,48 lít khí (đktc), 2.7 gam chất rắn. Khối lượng của Na và Al tương ứng là
A 7,8 gam và 5,4 gam B 2.3 gam và 5,4 gam C 3,9 gam và 8,1 gam D 15,6 gam và 5,4 gam
Câu 23: Chất nào sau đây không có tính lưỡng tính?
A NaHCO3 B Al(OH)3 C ZnSO4 D Al2O3
Câu 24: Oxi hóa 11,2 gam Fe bằng oxi được m gam hỗn hợp Y gồm Fe, FeO, Fe3O4, Fe2O3. Y tan hết trong HNO3 dư, sinh ra 0,06 mol NO (sản phẩm khử duy nhất). Giá trị của m là
A 7,56 B 6,56 C 5,66 D 14,56
Câu 25: Khử hoàn toàn m gam hỗn hợp X gồm FeO và Fe2O3 bằng H2 (t0), kết thúc thí nghiệm thu được 12,6 gam nước và 28 gam Fe. Phần trăm khối lượng FeO có trong X là
A 47,4%. B 18,4% C 27,8%. D 52,6%.
Câu 26: Để bảo quản kim loại kiềm, người ta
A ngâm chìm trong dầu hoả. B ngâm chìm vào dung dịch NaOH C cho vào lọ đậy kín. D ngâm chìm trong dung dịch muối ăn.
Câu 27: Cho Na vào dung dịch CuSO4 dư, dung dịch thu được sau phản ứng chứa các chất tan là
A Na2SO4, CuSO4, Cu(OH)2 B Na2SO4, Cu(OH)2 C Na2SO4, CuSO4. D Na2SO4, CuSO4, NaOH
Câu 28: Cho luồng khí CO dư đi qua ống sứ chứa hỗn hợp các chất sau: CaO, Al2O3, Fe2O3, CuO, nung nóng. Chất rắn còn lại trong ống sứ gồm
A Al, CaCO3, Fe, Cu. B Al2O3, Fe, Cu, CaO. C CaCO3, Al2O3, Fe, Cu. D Al2O3, Cu, Fe2O3, CaO.
Câu 29: Khi điện phân dung dịch NaCl, ở anot xảy ra
A sự khử Cl- B sự oxi hoá H2O C sự khử H2O D sự oxi hóa Cl-
Câu 30: X là hỗn hợp Al(OH)3, Ag2O, Cu(OH)2 và Zn(OH)2. Để tách Al(OH)3 ra khỏi hỗn hợp X, người ta cho X vào dung dịch
A HCl dư, sau đó cho dung dịch NaOH dư vào thì Al(OH)3 tách ra. B NaOH dư, sau đó cho dung dịch NH3 vừa đủ vào thì Al(OH)3 tách ra C NH3 dư, Al(OH)3 không tan tách ra D HCl dư, sau đó trung hòa axit dư băng dung dịch kiềm thì Al(OH)3 tách ra.
Câu 31: Nhóm các chất đều tác dụng được với Mg là
A H2SO4, Cl2, C2H5OH, O2. B HNO3, CH3COOH, O2, CuSO4. C H2O, HCl, O2, NaNO3 D HNO3, KOH, O2, S.
Câu 32: Các muối FeSO4, Fe2(SO4)3, KNO3, Na2CO3 có cùng nồng độ mol. Thứ tự pH tăng dần của chúng là
A KNO3 < Na2CO3 < FeSO4 < Fe2(SO4)3 B FeSO4 < Fe2(SO4)3 < KNO3 < Na2CO3 C Na2CO3 < KNO3 < FeSO4 < Fe2(SO4)3 D Fe2(SO4)3 < FeSO4 < KNO3 < Na2CO3
Nâng cao
Câu 33: Khi trộn lẫn các dung dịch FeCl3 và dung dịch Na2CO3 thì thấy có kết tủa
A đỏ nâu B đỏ nâu và sủi bọt khí C trắng D trắng và sủi bọt khí
Câu 34: Một dung dịch hỗn hợp chứa a mol NaAlO2 và a mol NaOH tác dụng với một dung dịch chứa b mol HCl. Điều kiện để thu được kết tủa sau phản ứng là:
A a < b < 5a B a = b C b = 5a D a = 2b
Câu 35: Cho Fe vào dung dịch AgNO3 loãng, dư thu được dung dịch (A) có chứa
A Fe(NO3)2 B Fe(NO3)2, AgNO3 C Fe(NO3)3, AgNO3 D Fe(NO3)3
Câu 36: Cho hỗn hợp Fe dư và Cu vào dung dịch HNO3 loãng thu được khí NO và dung dịch chứa
A Fe(NO3)2 B Fe(NO3)2, Fe(NO3)3 C Fe(NO3)2, Cu(NO3)2 D Fe(NO3)3
Câu 37: Nguyên tắc làm mềm nước cứng là
A đun nóng hoặc dùng hoá chất. B loại bỏ bớt ion Ca2+ và Mg2+ trong nước. C làm các muối tan của magie và canxi biến thành muối kết tủa. D dùng cột trao đổi ion.
Câu 38: Cho dung dịch chứa x gam Ba(OH)2 vào dung dịch chứa x gam HCl. Dung dịch thu được sau phản ứng có môi trường
A không xác định được. B axit. C trung tính. D bazơ.
Câu 39: A là dung dịch gồm 0,075 mol CuSO4 và 0,2 mol NaCl. Điện phân dung dịch A (điện cực trơ, màng ngăn xốp ) cho đến khi nước vừa bắt đầu điện phân ở cả hai điện cực thì ngừng lại. Dung dịch sau điện phân hòa tan vừa đủ x gam ZnO. Giá trị của x là
A 8,10 B 12,15 C 4,05 D 2,025
Câu 40: Dung dịch X chứa ion H; 0,02 mol Al3+; 0,01 mol Mg2+ và 0,045 mol SO. Thêm 0,045 mol NaOH và 0,03 mol Ba(OH)2 vào dung dịch X rồi khuấy đều. Khối lượng kết tủa thu được sau phản ứng là
A 9,13 gam B 1,36 gam C 8,35 gam D 7,96gam
Phần riêng
Cơ bản:
Câu 41: Cho Ca vào dung dịch NH4HCO3 thấy xuất hiện
A kết tủa trắng và khí mùi khai bay lên. B khí mùi khai bay lên. C kết tủa trắng. D kết tủa trắng sau đó tan dần.
Câu 42: Hỗn hợp Fe và Cu tác dụng với dung dịch HNO3 loãng, phản ứng xong thu được dung dịch A chỉ chứa một chất tan. Chất tan đó là
A Fe(NO3)2. B Cu(NO3)2. C HNO3. D Fe(NO3)3.
Câu 43: X là hỗn hợp bột gồm Cu, Ni, Sn, Zn. Cho X vào dung dịch AgNO3 khuấy đều, phản ứng xong được chất rắn Y gồm 3 kim loại. Kim loại trong Y là
A Ag, Cu, Ni B Zn, Ni, Sn C Zn, Ni, Cu D Ag, Cu, Sn
Câu 44: Hòa tan hết 19.2 gam hỗn hợp Mg, Al và Fe trong dung dịch H2SO4 thu được 38,4 gam muối sunfat. Cho lượng muối này tác dụng với dung dịch BaCl2 dư thì khối lượng kết tủa thu được là
A 32,62 gam. B 23,30 gam. C 46,6 gam. D 18,64 gam.
Câu 45: Có các dung dịch NaCl, FeCl3, MgCl2, AlCl3, CuCl2. Để phân biệt các dung dịch trên người ta dùng dung dịch
A AgNO3 B H2SO4 loãng C NaOH D BaCl2
Câu 46: Cho Ba vào dung dịch có chứa ion NH4+, K+, CO32-, SO42-. Số phản ứng xảy ra tối đa là
A 5. B 3. C 4. D 2.
Câu 47: Để nhận biết ion Fe2+ trong dung dịch ta dùng dung dịch
A NaCl. B KOH. C K2SO4. D NaNO3.
Câu 48: Để tác dụng hết với 6,14gam hỗn hợp FeO , Fe2O3, Fe3O4 cần dùng vừa đủ 160ml dung dịch HCl 1M. Nếu khử hoàn toàn 6,14 gam hỗn hợp trên bằng khí CO ở nhiệt độ cao thì khối lượng Fe thu được là:
A 3,63 gam B 4,86 gam C 4,36 gam D 4,63 gam
ĐÁP ÁN
1. C 2. B 3. A 4. A 5. A 6. C 7. B 8. D 9. C 10. B 11. A 12. C 13. A 14. D 15. D 16. C 17. B 18. D 19. D 20. B 21. A 22. B 23. C 24. D 25. B 26. A 27. C 28. C 29. D 30. A 31. B 32. D 33. B 34. A 35. C 36. A 37. B 38. D 39. D 40. D 41. A 42. A 43. D 44. C 45. C 46. C 47. B 48. B
ĐỀ 3 |
Cho nguyên tử khối của các nguyên tố: H: 1; Li: 7; C: 12; N: 14; O: 16; Na: 23;Mg: 24;Al: 27; S: 32; Cl: 35,5; K: 39; Ca:40; Cr: 52; Fe: 56; Cu: 64; Zn: 65;Br: 80; Ba: 137; Ag: 108;Cs: 133
Câu 1: Cho hỗn hợp gồm 8,4 gam sắt và 3,6 gam Mg tác dụng với dung dịch H2SO4 loãng dư, thể tích khí (ở đktc) thu được sau phản ứng là
A. 6,72 lít. B. 10,08 lít. C. 8,96 lít. D. 8,4 lít.
Câu 2: Điện phân dung dịch CuSO4 nồng độ 0,5M với điện cực trơ trong thì thu được 1gam Cu. Nếu dùng dòng điện một chiều có cường độ 1A, thì thời gian điện phân tối thiểu có giá trị gần nhất là
A. 40 phút 45 giây. B. 40 phút 15 giây. C. 50 phút 15 giây. D. 50 phút 45 giây.
Câu 3: Cho 25 gam hỗn hợp bột gồm 5 oxit kim loại ZnO, FeO, Fe3O4, MgO, Fe2O3 tác dụng vừa đủ với 200 ml dung dịch HCl 2M. Kết thúc phản ứng, khối lượng muối có trong dung dịch X là
A. 36,0 gam. B. 39,6 gam. C. 38,0 gam. D. 39,2 gam.
Câu 4: Tiến hành bốn thí nghiệm sau:
- Thí nghiệm 1: Nhúng thanh Fe vào dung dịch FeCl3;
- Thí nghiệm 2: Nhúng thanh Fe vào dung dịch CuSO4;
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3;
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl.
Số trường hợp xuất hiện ăn mòn điện hoá là
A. 1. B. 4. C. 2. D. 3.
Câu 5: Cho các chất: Al, AlCl3, Al2O3, Al(OH)3. Số chất có tính lưỡng tính là
A. 3. B. 2. C. 4. D. 1.
Câu 6: Có các kim loại Cu, Ag, Fe, Al, Au. Độ dẫn điện của chúng giảm dần theo thứ tự
A. Ag, Cu, Au, Al, Fe. B. Au, Ag, Cu, Al, Fe.
C. Ag, Au, Cu, Fe, Al. D. Ag, Cu, Fe, Al, Au.
Câu 7: Hiện tượng nào dưới đây được mô tả không đúng?
A. Cho bột Cu vào dung dịch FeCl3 màu vàng nâu, màu của dung dịch chuyển dần sang màu xanh.
B. Thêm NaOH vào dung dịch FeCl3 màu vàng nâu thấy xuất hiện kết tủa trắng xanh.
C. Cho bột sắt vào dung dịch FeCl3 thấy màu vàng nâu của dung dịch bị nhạt dần.
D. Cho CO2 đến vào dung dịch Ca(OH)2 thấy có kết tủa sau đó tan khi CO2 dư.
Câu 8: Dãy các ion xếp theo chiều giảm dần tính oxi hoá là
A. Ag+, Cu2+, Fe3+, Fe2+. B. Fe3+, Cu2+, Ag+, Fe2+.
C. Ag+, Fe3+, Cu2+, Fe2+. D. Fe3+, Ag+, Cu2+, Fe2+.
Câu 9: Sắt (Fe) ở ô số 26 của bảng tuần hoàn các nguyên tố hóa học. Cấu hình electron của ion Fe2+ là
A. [Ar] 3d54s1. B. [Ar]3d6. C. [Ar]3d64s2. D. [Ar] 3d44s2.
Câu 10: Cho các chất và ion sau: Fe; FeSO4; FeO; Fe3O4; Fe(NO3)3; FeCl2; Fe2+; Fe3+. Số lượng chất và ion có khả năng vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa là
A. 5. B. 4. C. 6. D. 3.
Câu 11: Nhiệt phân hoàn toàn 40g một loại quặng đôlômit có lẫn tạp chất trơ, sinh ra 8,96 lít CO2 (đktc). Thành phần % về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên là
A. 84%. B. 92%. C. 50%. D. 40%.
Câu 12: Cho các kim loại: Au, Al, Cu, Ag, Zn. Số kim loại tác dụng được với dung dịch H2SO4 loãng là
A. 5. B. 2. C. 4. D. 3.
Câu 13: Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M; lượng kết tủa thu được là 15,6g. Giá trị lớn nhất của V là
A. 2,4. B. 2,0. C. 1,2. D. 1,8.
Câu 14: Hồng ngọc (Ruby), là một loại đá quý thuộc về loại khoáng chất corundum. Chỉ có những corundum màu đỏ mới được gọi là hồng ngọc, các loại corundum khác được gọi là Sa-phia. Chất cấu tạo nên Sa-phia, hồng ngọc có công thức phân tử là
A. Fe2O3. B. Cr2O3. C. Al2O3. D. C (cacbon).
Câu 15: Nước cứng gây ra nhiều tác hại trong đời sống cũng như trong sản xuất. Một mẫu nước cứng chứa các ion: Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất được dùng để làm mềm mẫu nước cứng trên là
A. NaOH. B. Na2CO3. C. Ca(OH)2. D. HCl.
Câu 16: Nhận xét nào sau đây sai?
A. Nguyên tắc điều chế kim loại là oxi hóa ion kim loại thành nguyên tử kim loại.
B. Những tính chất vật lí chung của kim loại chủ yếu do các electron tự do trong mạng tinh thể kim loại gây ra.
C. Nguyên tử của hầu hết các nguyên tố kim loại có ít electron ở lớp ngoài cùng.
D. Tính chất hóa học chung của kim loại là tính khử.
Câu 17: Cho mạt sắt dư vào dung dịch X. Khi phản ứng kết thúc thấy khối lượng chất rắn giảm so với ban đầu. Dung dịch X có thể là
A. dung dịch FeCl3. B. dung dịch NiSO4.
C. dung dịch AgNO3. D. dung dịch CuSO4.
Câu 18: Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng (dư), thu được dung dịch X. Trong các chất: NaOH, Cu, Fe(NO3)3, KMnO4, BaCl2, Cl2 và Al, số chất có khả năng phản ứng được với dung dịch X là
A. 4. B. 7. C. 5. D. 6.
Câu 19: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 49,09. B. 35,50. C. 38,72. D. 34,36.
Câu 20: Chọn phương trình hóa học sai
A. CuO + 2HCl → CuCl2 + H2O. B. Na2CO3 + CaCl2 → CaCO3 + 2NaCl.
C. NaHCO3 + NaOH → Na2CO3 + H2O. D. 2Fe + 6HCl → 2FeCl3 + 3H2.
Câu 21: Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3. Hiện tượng xảy ra là
A. Xuất hiện kết tủa trắng, kết tủa không tan khi Ba(OH)2 dư.
B. Lúc đầu không xuất hiện kết tủa, sau đó có kết tủa trắng xuất hiện khi Ba(OH)2 dư.
C. Xuất hiện kết tủa trắng, sau đó tan một phần khi Ba(OH)2 dư.
D. Xuất hiện kết tủa trắng, sau đó tan hết khi Ba(OH)2 dư.
Câu 22: Hòa tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 vừa đủ, thu được dung dịch X (chỉ chứa 2 muối sunfat) và V lít (đktc) khí duy nhất NO. Giá trị của a và V lần lượt là
A. 0,04 mol và 8,96 lít. B. 0,12 mol và 17,92 lít.
C. 0,06 mol và 17,92 lít. D. 0,075mol và 8,96 lít.
Câu 23: Hợp chất được dùng để đúc tượng, bó bột khi gãy xương là
A. Vôi tôi. B. Thạch cao sống. C. Thạch cao nung. D. Vôi sống.
Câu 24: Tiến hành thí nghiệm như hình vẽ:
|
|
|
|
|
|
| ||||||
| ||||||
|
Nếu cho dung dịch NaOH đến dư thì số ống nghiệm thu được kết tủa khi phản ứng hoàn toàn là
A. 3. B. 1. C. 4. D. 2.
Câu 25: Công thức oxit của kim loại kiềm có dạng
A. RO. B. R2O3. C. R2O. D. RO2.
Câu 26: Hòa tan hết 34,8g FexOy bằng dung dịch HNO3 loãng, thu được dung dịch A. Cho dung dịch NaOH dư vào dung dịch A. Kết tủa thu được đem nung ở nhiệt độ cao cho đến khối lượng không đổi. Dùng H2 để khử hết lượng oxit tạo thành sau khi nung thu được 25,2g chất rắn. FexOy là
A. Fe2O3. B. Fe3O4. C. FeO. D. FeO hoặc Fe2O3.
Câu 27: Hòa tan một lượng gồm hai kim loại kiềm vào nước thu được 100 ml dung dịch A và 112 ml khí H2 (đktc). Giá trị pH của dung dịch A là
A. 1. B. 2. C. 12. D. 13.
Câu 28: Hoà tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dung dịch X và 8,736 lít khí H2(ở đktc). Cô cạn dung dịch X thu được lượng muối khan là
A. 29.55 gam. B. 38,93 gam. C. 25,95 gam. D. 77,96 gam.
Câu 29: Kim loại nhôm tan được trong
A. dung dịch HNO3 đặc, nguội. B. dung dịch NaCl.
C. dung dịch NaOH. D. Nước.
Câu 30: Cho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Tổng nồng độ phần trăm khối lượng của các chất tan trong dung dịch sau phản ứng là
A. 51,08%. B. 55,45%. C. 45,11%. D. 42,17%.
-----Hết-----
ĐÁP ÁN
ĐÁP ÁN
1 | A | 6 | A | 11 | B | 16 | A | 21 | C | 26 | B |
2 | C | 7 | B | 12 | B | 17 | A | 22 | C | 27 | D |
3 | A | 8 | C | 13 | B | 18 | B | 23 | C | 28 | B |
4 | C | 9 | B | 14 | C | 19 | C | 24 | D | 29 | C |
5 | B | 10 | C | 15 | B | 20 | D | 25 | C | 30 | C |
ĐỀ 4 |
Câu 1: Cho các phát biểu sau:
(a) NaHCO3 được dùng làm thuốc chữa đau dạ dày do thừa axit.
(b) Ở nhiệt độ thường, tất cả các kim loại kiềm đều tác dụng được với nước.
(c) Công thức hóa học của thạch cao nung là CaSO4.H2O.
(d) Al(OH)3, NaHCO3, Al2O3 là các chất có tính chất lưỡng tính.
(e) Có thể dùng dung dịch NaOH để làm mềm nước cứng tạm thời.
Số phát biểu đúng là
A. 2. B. 4. C. 3. D. 5.
Câu 2: Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là :
A. vôi sống. B. Muối ăn. C. Cát. D. Lưu huỳnh.
Câu 3: Hỗn hợp A gồm 0,56g Fe và 16g Fe2O3, m (mol) Al rồi nung ở nhiệt độ cao không có không khí được hỗn hợp D. Nếu cho D tan trong H2SO4 loãng được V(lít) khí nhưng nếu cho D tác dụng với NaOH dư thì thu được 0,25V lít khí. Gía trị gần nhất của m là?
A. 0,12. B. 0,1233. C. 0,2467. D. 0,3699
Câu 4: Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là
A. 4,99%. B. 4,00%. C. 5,00%. D. 6,00%.
Câu 5: Sục từ từ CO2 vào V lít dung dịch Ca(OH)2 0,5M. Kết quả thí nghiệm biểu diễn trên đồ thị sau:
Giá trị của V là
A. 0,10. B. 0,05. C. 0,20. D. 0,80.
Câu 6: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác, trong đó hàm lượng cacbon chiếm
A. từ 2% đến 5%. B. từ 0,01% - 2%. C. trên 5%. D. từ 2% - 3%.
Câu 7: Dẫn một luồng hơi nước qua than nóng đỏ thì thu được V lít (ở đktc) hỗn hợp khí X gồm CO2, CO, H2, tỉ khối hơi của X so với H2 là 7,8. Toàn bộ V lít hợp khí X trên khử vừa đủ 24 gam hỗn hợp CuO, Fe2O3 nung nóng thu được rắn Y chỉ có 2 kim loại. Ngâm toàn bộ Y vào dung dịch HCl dư thấy có 4,48 lít H2 bay ra (ở đktc). Giá trị V là
A. 11,20 lít. B. 10,08 lít. C. 8,96 lít. D. 13,44 lít.
Câu 8: Cho thứ tự bốn cặp oxi-hóa khử trong dãy điện hóa như sau: Na+/Na; Mg2+/Mg; Al3+/Al; Ag+/Ag. Kim loại nào có tính khử mạnh nhất trong các kim loại sau?
A. Ag. B. Al. C. Na. D. Mg.
Câu 9: Al2O3 phản ứng được với cả hai dung dịch
A. NaCl, H2SO4. B. NaOH, HCl. C. KCl, NaNO3. D. Na2SO4, KOH.
Câu 10: Quặng hematit nâu có chứa
A. Fe2O3 khan. B. Fe3O4. C. FeCO3. D. Fe2O3.nH2O.
Câu 11: Hòa tan hết m gam hỗn hợp gồm Al, Zn, Mg cần 2,08 mol HNO3 thu được 0,1 mol N2O; x mol N2. Cô cạn dung dịch được 132 gam muối khan. Giá trị của x, m lần lượt là (không có sản phẩm khử khác của N+5).
A. 0,128; 3,04. B. 0,090; 26,60. C. 0,128; 26,60. D. 0,090; 3,04.
Câu 12: Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm thổ là
A. ns2np2. B. ns2np1. C. ns2. D. ns1.
Câu 13: Nước có chứa các ion : Ca2+, Mg2+, HCO3-, SO42- và Cl- gọi là
A. Nước có tính cứng vĩnh cữu. B. Nước có tính cứng tạm thời.
C. Nước có tính cứng toàn phần. D. Nước mềm.
Câu 14: Dung dịch HCl, H2SO4 loãng sẽ oxi hóa crom đến mức oxi hóa nào?
A. +4. B. +6. C. +2. D. +3.
Câu 15: Có bốn thanh sắt được đặt tiếp xúc với những kim loại khác nhau và nhúng trong các dung dịch HCl như hình vẽ dưới đây:
Thanh sắt bị hòa tan chậm nhất sẽ là thanh được đặt tiếp xúc với:
A. Ni. B. Zn. C. Cu. D. Sn.
Câu 16: Nung m gam Fe(OH)3 ở nhiệt độ cao đến khối lượng không đổi, thu được 7,2 gam một oxit. Giá trị của m là
A. 10,7. B. 21,4 C. 16. D. 9,63.
Câu 17: Nhận định nào sau đây đúng khi cho Ca vào dung dịch Na2CO3 ?
A. Ca tác dụng với nước, đồng thời dung dịch đục do Ca(OH)2 ít tan.
B. Ca khử Na+ thành Na, dung dịch xuất hiện kết tủa trắng CaCO3.
C. Ca tan trong nước sủi bọt khí H2, dung dịch xuất hiện kết tủa trắng CaCO3.
D. Ca khử Na+ thành Na, Na tác dụng với nước tạo H2 bay hơi, dung dịch xuất hiện kết tủa trắng.
Câu 18: Kim loại nào sau đây có thể tác dụng với nước ở điều kiện thường tạo ra dung dịch làm xanh giấy quỳ tím là
A. Ba. B. Fe. C. Zn. D. Be.
Câu 19: Cho phương trình hóa học phản ứng oxi hóa hợp chất Fe(II) bằng oxi không khí:
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
Kết luận nào sau đây là đúng?
A. O2 là chất khử, H2O là chất oxi hoá.
B. Fe(OH)2 là chất khử, H2O là chất oxi hoá.
C. Fe(OH)2 là chất khử, O2 và H2O là chất oxi hoá.
D. Fe(OH)2 là chất khử, O2 là chất oxi hoá.
Câu 20: Hoà tan hoàn toàn 33,1g hỗn hợp Mg, Fe, Zn vào trong dung dịch H2SO4 loãng dư thấy có 13,44 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
A. 90,7g B. 75,5g C. 78,7g D. 74,6g
Câu 21: Crom có số hiệu nguyên tử là 24. Cấu hình electron của ion Cr3+ là
A. [Ar]3d4. B. [Ar]3d2. C. [Ar]3d5. D. [Ar]3d3.
Câu 22: Cho sơ đồ sau:
Công thức của X, Y, Z lần lượt là:
A. HCl, HNO3, Na2NO3. B. Cl2, AgNO3, MgCO3.
C. Cl2, HNO3, CO2. D. HCl, AgNO3, (nh4)2CO3.
Câu 23: Phèn chua có công thức hóa học là M2SO4.Al2(SO4)3.24H2O. M là
A. NH4. B. Na. C. K. D. Li.
Câu 24: Cho luồng khí CO dư đi qua hỗn hợp X gồm: Al2O3, ZnO, Fe2O3, CuO nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y gồm
A. Al2O3, Zn, Fe, Cu. B. Al, Zn, Fe, Cu.
C. Al2O3, ZnO, Fe, Cu. D. Al2O3, ZnO, Fe2O3, Cu.
Câu 25: Tiến hành các thí nghiệm sau:
(1) Cho bột Fe vào dung dịch AgNO3.
(2) Cho Fe vào dung dịch Fe2(SO4)3 dư.
(3) Cho dung dịch FeCl2 vào dung dịch AgNO3 (dư).
(4) Dẫn khí CO (dư) qua bột Fe2O3 nung nóng.
Số thí nghiệm có tạo thành kim loại là
A. 1. B. 2. C. 4. D. 3.
Câu 26: Cho 350 ml dung dịch NaOH 2M vào 100 ml dung dịch AlCl3 2M, thu được kết tủa có khối lượng là:
A. 0,0 gam. B. 7,8 gam. C. 18,2 gam. D. 15,6 gam.
Câu 27: Cho 20 gam hỗn hợp X gồm Fe, FeO, Fe3O4, Fe2O3 tan vừa hết trong 700 ml dung dịch HCl 1M, thu được 3,36 lít H2 (đktc) và dung dịch Y. Cho dung dịch Y tác dụng với NaOH dư, lọc kết tủa và nung trong không khí đến khối lượng không đổi thu được chất rắn Y. Khối lượng Y là
A. 24 gam. B. 8 gam. C. 16 gam. D. 32 gam.
Câu 28: Điện phân với điện cực trơ dung dịch chứa 0,2 mol Cu(NO3)2, cường độ dòng điện 2,68A, trong thời gian t (giờ), thu được dung dịch X. Cho 14,4 gam bột Fe vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và 13,5 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn và hiệu suất của quá trình điện phân là 100%. Giá trị gần nhất của t là
A. 1,00. B. 1,20. C. 0,25. D. 0,60.
Câu 29: Cho bột Fe vào dung dịch AgNO3 dư, sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch gồm các chất tan:
A. Fe(NO3)2, AgNO3, Fe(NO3)3. B. Fe(NO3)2, AgNO3.
C. Fe(NO3)3, AgNO3. D. Fe(NO3)2, Fe(NO3)3.
Câu 30: Để sản xuất nhôm trong công nghiệp người ta
A. Điện phân Al2O3 nóng chảy có mặt criolit.
B. Điện phân dung dịch AlCl3.
C. Cho CO dư đi qua Al2O3 nung nóng.
D. Cho Mg vào dung dịch Al2(SO4)3.
------ HẾT ------
ĐÁP ÁN
ĐÁP ÁN
1 | D | 6 | B | 11 | B | 16 | D | 21 | D | 26 | B |
2 | D | 7 | A | 12 | C | 17 | C | 22 | D | 27 | A |
3 | C | 8 | C | 13 | C | 18 | A | 23 | C | 28 | A |
4 | C | 9 | B | 14 | C | 19 | D | 24 | A | 29 | C |
5 | C | 10 | D | 15 | B | 20 | A | 25 | D | 30 | A |
ĐỀ 5 |
Câu 1: Để thu được kim loại Cu từ dung dịch Cu(NO3)2 theo phương pháp thuỷ luyện, có thể dùng kim loại nào sau đây?
A. Zn. B. Ca. C. Na. D. Rb.
Câu 2: Nước cứng vĩnh cửu có chứa các ion
A. Mg2+; Na+; . B. K+; Na+; ; . C. Mg2+; Ca2+; . D. Mg2+; Ca2+; .
Câu 3: Dãy cation kim loại được sắp xếp theo chiều tăng dần tính oxi hóa từ trái sang phải là
A. Mg2+, Fe2+ , Cu2+. B. Cu2+, Fe2+, Mg2+ . C. Mg2+, Cu2+, Fe2+. D. Cu2+, Mg2+, Fe2+.
Câu 4: Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, Al2O3, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm
A. Cu, Fe, Al2O3, MgO. B. Cu, Fe, Al, MgO. C. Cu, FeO, Al2O3, MgO. D. Cu, Fe, Al, Mg.
Câu 5: Cho một thanh sắt nặng 20 gam vào 200ml dung dịch CuSO4 0,5M. Sau phản ứng, rửa sạch, sấy khô thanh sắt và đem cân lại có khối lượng là
A. 5,6 gam. B. 6,4 gam. C. 20,8 gam. D. 19,2 gam.
Câu 6: Cho một mẫu hợp kim Na-K-Ca tác dụng với nước (dư), thu được dung dịch X và 3,36 lít H2 (đktc). Thể tích dung dịch axit HCl 1,5M cần dùng để trung hoà một phần hai dung dịch X là
A. 75 ml. B. 150 ml. C. 100 ml. D. 50 ml.
Câu 7: Tiến hành các thí nghiệm sau
(1) Ngâm lá đồng trong dung dịch AgNO3; (2) Ngâm lá kẽm trong dung dịch HCl loãng;
(3) Ngâm lá sắt được cuốn dây đồng trong dung dịch HCl;
(4) Để một vật bằng gang ngoài không khí ẩm; (5) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3.
Số thí nghiệm xảy ra ăn mòn hóa học là
A. 3. B. 1. C. 2. D. 4.
Câu 8: Điện phân 500 ml dung dịch AgNO3 với điện cực trơ cho đến khi catot bắt đầu có khí thoát ra thì ngừng lại. Để trung hòa dung dịch sau điện phân cần 800 ml dung dịch NaOH 1M. Nồng độ mol AgNO3 và thời gian điện phân là bao nhiêu (biết I = 20A)?
A. 1,6M, 360 giây. B. 0,4M, 380 giây. C. 0,8M, 3860 giây. D. 1,6M, 3860 giây.
Câu 9: Dụng cụ không dùng để đựng dung dịch nước vôi trong là
A. cốc sắt. B. cốc thủy tinh. C. cốc nhôm. D. cốc nhựa.
Câu 10: Nung 24gam một hỗn hợp Fe2O3 và CuO trong một luồng khí H2 dư. Phản ứng hoàn toàn. Cho hỗn hợp khí tạo ra trong phản ứng đi qua bình đựng H2SO4 đặc thấy khối lượng của bình này tăng lên 7,2 gam. Vậy khối lượng Fe và Cu thu được sau phản ứng là:
A. 11,2g Fe; 3,2g Cu B. 11,2g Fe; 6,4g Cu C. 5,6g Fe; 3,2g Cu D. 5,6g Fe; 6,4g Cu
Câu 11: Cho 19,6 gam hỗn hợp gồm K, Al, Zn tác dụng với dung dịch H2SO4 loãng, dư, thu được 11,2 lít H2 (đktc). Cô cạn dung dịch thu được muối khan có khối lượng bằng:
A. 67,6 gam. B. 68,6 gam. C. 43,6 gam. D. 28,4 gam.
Câu 12: Chất phản ứng vừa phản ứng được với dung dịch NaOH, vừa phản ứng với dung dịch HCl là
A. CuO. B. Al2O3. C. KOH. D. MgO.
Câu 13: Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p1. Số hiệu nguyên tử của X là
A. 14. B. 15. C. 27. D. 13.
Câu 14: Ở nhiệt độ thường, kim loại Na phản ứng với nước tạo thành
A. Na2O và H2. B. NaOH và H2. C. NaOH và O2. D. Na2O và O2.
Câu 15: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có hiện tượng
A. kết tủa trắng xuất hiện. B. không có hiện tượng.
C. kết tủa trắng, sau đó kết tủa tan dần. D. bọt khí và kết tủa trắng.
Câu 16: Hòa tan hoàn toàn 2,8 gam hỗn hợp FeO, Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M, thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 3 gam chất rắn. Tính V ?
A. 125 B. 175 C. 62,5 D. 87,5
Câu 17: Cặp kim loại nào sau đây đều không tác dụng với dung dịch axit H2SO4 loãng?
A. Mg, K. B. Ag, Cu. C. Fe, Cu. D. Na, Ag
Câu 18: Cho hỗn hợp rắn A gồm 5,6 gam Fe và 6,4 gam Cu tác dụng với 300 ml dung dịch AgNO3 2M khi phản ứng hoàn toàn khối lượng chất rắn thu được là
A. 64,8 gam. B. 21,6 gam. C. 54,0 gam. D. 43,2 gam.
Câu 19: Hợp chất sắt(II) hiđroxit có màu gì?
A. Màu vàng. B. Màu trắng hơi xanh. C. Màu đen. D. Màu trắng.
Câu 20: Nung hỗn hợp X gồm Al, Fe2O3 được hỗn hợp Y (hiệu suất 100%). Hòa tan hết Y bằng HCl dư được 2,24 lít khí (đktc), cũng lượng Y này nếu cho phản ứng với dung dịch NaOH dư thấy còn 8,8g rắn Z. Khối lượng các chất trong X là?
A. mAl=5,4g, mFe2O3=1,12g B. mAl=5,4g, mFe2O3=11,2g
C. mAl=2,7g, mFe2O3=11,2g D. mAl=2,7g, mFe2O3=1,12g
Câu 21: Hòa tan hoàn toàn 1,6 gam Cu bằng dung dịch HNO3, thu được x mol NO2 (là sản phẩm khử duy nhất của N+5). Giá trị của x là
A. 0,15. B. 0,25. C. 0,10. D. 0,05.
Câu 22: Một loại nước cứng có chứa các ion: Ca2+, Mg2+, Cl- và SO42-. Hóa chất nào trong số các chất sau đây có thể làm mềm loại nước cứng trên?
A. K2CO3. B. KNO3. C. NaOH. D. NaCl.
Câu 23: Cho các hợp kim sau: Al – Zn (1); Fe – Zn (2); Zn – Cu (3); Mg – Zn (4). Khi tiếp xúc với dung dịch axit H2SO4 loãng thì các hợp kim mà trong đó Zn bị ăn mòn điện hóa học là
A. (2), (3) và (4). B. (2) và (3). C. (1), (2) và (3). D. (3) và (4).
Câu 24: Kim loại nào sau đây có tính khử mạnh nhất trong số các kim loại Fe, K, Al, Na
A. Al. B. Na. C. Fe. D. K.
Câu 25: Hấp thụ hết 0,3 mol khí CO2 vào 2 lít dung dịch hỗn hợp Ba(OH)2 0,025M và NaOH 0,15M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là:
A. 39,40 B. 39,80 C. 19,70 D. 9,85
Câu 26: Kim loại dẫn điện tốt nhất là
A. Cu. B. Ag. C. Au. D. Al.
Câu 27: Sục từ từ khí CO2 vào dung dịch natri aluminat đến dư thì
A. tạo kết tủa Al(OH)3, phần dung dịch chứa NaHCO3.
B. tạo kết tủa Al(OH)3, phần dung dịch chứa Na2CO3.
C. không có phản ứng xảy ra. D. tạo kết tủa Al(OH)3, sau đó kết tủa bị hòa tan lại.
Câu 28: Cho phương trình hóa học phản ứng oxi hóa hợp chất Fe(II) bằng oxi không khí:
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
Kết luận nào sau đây là đúng?
A. Fe(OH)2 là chất khử, O2 và H2O là chất oxi hoá. B. Fe(OH)2 là chất khử, H2O là chất oxi hoá.
C. O2 là chất khử, H2O là chất oxi hoá. D. Fe(OH)2 là chất khử, O2 là chất oxi hoá.
Câu 29: Phát biểu nào sau đây là sai?
A. Thạch cao nung (CaSO4.2H2O) được dùng để bó bột, đúc tượng.
B. Na2CO3 là nguyên liệu quan trọng trong công nghiệp sản xuất thủy tinh.
C. Thành phần chính của quặng đolomit là CaCO3.MgCO3.
D. Các kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa.
Câu 30: Cho các kim loại sau: Li, Na, Al, Ca. Số kim loại kiềm thổ trong dãy là
A. 1. B. 2. C. 3. D. 4.
ĐÁP ÁN
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
A | D | A | A | C | C | C | D | C | B | A | B | D | B | C |
16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
D | B | C | B | C | D | A | B | D | D | B | A | D | A | A |
XEM THÊM:
- Đề cương ôn thi tốt nghiệp môn hóa 12 violet
- Đề thi hóa 12 học kì 2 có đáp án
- Đề cương ôn tập học kì 2 môn hóa 12
- Các câu hỏi lý thuyết hóa hữu cơ lớp 12
- Lý thuyết và các dạng bài tập hóa hữu cơ 12
- Một số công thức giải nhanh hóa học 12
- Tóm tắt lý thuyết hóa học lớp 12
- câu hỏi trắc nghiệm lý thuyết hóa vô cơ 12
- Tài liệu ôn thi thpt quốc gia môn hóa
- Đề thi khảo sát môn hóa lớp 12
- Đề Thi HSG Hóa 12 Cấp Trường
- Luyện giải nhanh các bài toán trắc nghiệm Hóa học PDF
- Tuyển tập câu hỏi trắc nghiệm hóa học
- ĐỀ KHẢO SÁT LẦN 1 Môn HOÁ HỌC 12
- Đề thi HSG Hóa 12 Trắc Nghiệm
- Đề thi khảo sát môn hóa lớp 12
- Tài liệu ôn tập môn hóa học lớp 12 thpt
- Lý thuyết trọng tâm về nhôm và hợp chất
- câu hỏi trắc nghiệm về điện phân
- Đề thi cuối học kì 1 lớp 12 môn hóa
- Đề thi hóa hk1 lớp 12
- Đề thi cuối học kì 1 lớp 12 môn hóa
- Đề kiểm tra học kì 1 môn hóa lớp 12
- Ôn tập hóa hk1 lớp 12
- Đề kiểm tra học kì 1 môn hóa 12
- Đề Thi Học Sinh Giỏi Hóa 12
- Đề Thi HSG Môn Hóa 12
- Đề Thi HSG 12 Môn Hóa
- Đề Thi Toán 12 Học Kì 1
- Đề thi hóa 12 học kì 1 có đáp án
- GIÁO ÁN HÓA HỌC 12 CV5512
- Đề Thi Học Sinh Giỏi Hóa 12
- Đề Thi HSG Hóa 12
- Bảng tóm tắt lý thuyết và công thức hóa 12
- Đề thi khảo sát môn hóa lớp 12
- Tài liệu ôn thi thpt quốc gia 2022 môn hóa
- Đề kiểm tra giữa kì hóa 12 có đáp án
- Các dạng bài tập hóa trong đề thi đại học 2021
- Chuyên đề sắt và một số kim loại quan trọng
- Đề kiểm tra giữa kì 2 hóa 12 có đáp án
- Chuyên đề kim loại kiềm kiềm thổ và nhôm
- Chuyên đề đại cương về kim loại lớp 12
- Đề kiểm tra giữa học kì 2 môn hóa 12
- Đề kiểm tra hóa 12 giữa học kì 2
- Đề thi giữa học kì 2 môn Hóa lớp 12 có đáp án
- Đề thi giữa học kì 2 lớp 12 môn Hóa có đáp án
- Bảng Tóm Tắt Lý Thuyết Hóa 12
- Đề thi cuối học kì 2 môn hóa lớp 12
- Đề thi hóa 12 học kì 2 có đáp án
- kIẾN THỨC HÓA 12 HỌC KÌ 2




