- Tham gia
- 28/1/21
- Bài viết
- 86,007
- Điểm
- 113
tác giả
Chuyên đề học sinh giỏi hóa THPT NĂM 2021 - 2022: Hóa học - Chuyên đề Cấu tạo nguyên tử
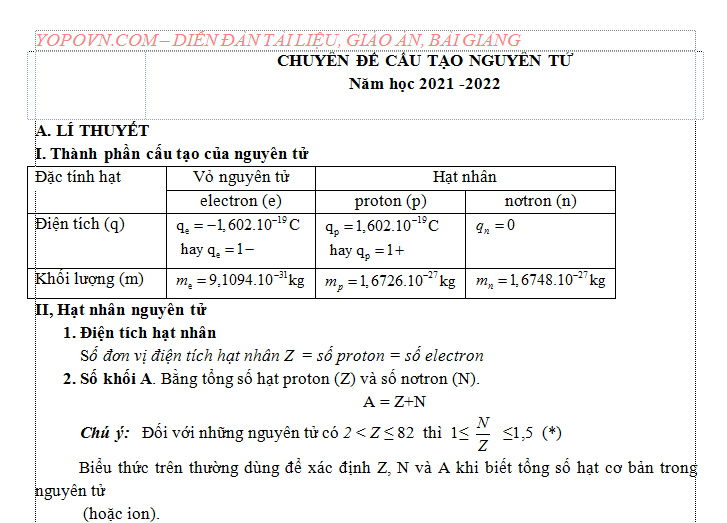
A. LÍ THUYẾT
I. Thành phần cấu tạo của nguyên tử
II, Hạt nhân nguyên tử
1. Điện tích hạt nhân
Số đơn vị điện tích hạt nhân Z = số proton = số electron
2. Số khối A. Bằng tổng số hạt proton (Z) và số nơtron (N).
Chú ý: Đối với những nguyên tử có 2 < Z ≤ 82 thì 1≤ ≤1,5 (*)
Biểu thức trên thường dùng để xác định Z, N và A khi biết tổng số hạt cơ bản trong nguyên tử
(hoặc ion).
III. Nguyên tố hoá học
1. Định nghĩa: Nguyên tố hoá học là tập hợp các nguyên tử có cùng số điện tích hạt nhân.
2. Số hiệu nguyên tử: Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số
hiệu nguyên tử của nguyên tố đó.
3. Kí hiệu nguyên tử
Nguyên tử của nguyên tố X có số hiệu nguyên tử Z và số khối A, được kí hiệu .
IV. Đồng vị
1. Định nghĩa: Các đồng vị của cùng một nguyên tố hoá học là những nguyên tử có cùng số
proton nhưng khác số nơtron, do đó số khối A của chúng khác nhau.
2. Nguyên tử khối và nguyên tử khối trung bình
• Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
• Giả sử nguyên tố A có hai đồng vị A1 và A2. Gọi là nguyên tử khối trung bình, A1 là nguyên tử khối của đồng vị A1, x1 là tỉ lệ phần trăm số nguyên tử của đồng vị A1; A2 là nguyên tử khối của đồng vị A2, x2 là tỉ lệ phần trăm số nguyên tử đồng vị A2.
Ta có:
Tổng quát:
V. Vỏ nguyên tử
1. Sự chuyển động của electron trong nguyên tử
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định nào. Vì chuyển động rất nhanh nên electron tạo thành quanh hạt nhân một vùng không gian mang điện âm gọi là mây electron hay obitan nguyên tử.
2. Obitan
Obitan nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90%. Obitan nguyên tử được kí hiệu là AO (Atomic Orbital).
3. Hình dạng obitan nguyên tử
Khi chuyển động trong nguyên tử, các electron có thể chiếm những mức năng lượng khác nhau đặc trưng cho trạng thái chuyển động của nó.
Những electron chuyển động gần hạt nhân hơn, chiếm những mức năng lượng thấp hơn tức là ở trạng thái bền hơn, những electron chuyển động ở xa hạt nhân có năng l
| CHUYÊN ĐỀ CẤU TẠO NGUYÊN TỬ Năm học 2017-2018 |
I. Thành phần cấu tạo của nguyên tử
| Đặc tính hạt | Vỏ nguyên tử | Hạt nhân | |
electron (e) | proton (p) | nơtron | |
| Điện tích (q) | |||
| Khối lượng (m) |
1. Điện tích hạt nhân
Số đơn vị điện tích hạt nhân Z = số proton = số electron
2. Số khối A. Bằng tổng số hạt proton (Z) và số nơtron (N).
A = Z+N
Chú ý: Đối với những nguyên tử có 2 < Z ≤ 82 thì 1≤ ≤1,5 (*)
Biểu thức trên thường dùng để xác định Z, N và A khi biết tổng số hạt cơ bản trong nguyên tử
(hoặc ion).
III. Nguyên tố hoá học
1. Định nghĩa: Nguyên tố hoá học là tập hợp các nguyên tử có cùng số điện tích hạt nhân.
2. Số hiệu nguyên tử: Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số
hiệu nguyên tử của nguyên tố đó.
3. Kí hiệu nguyên tử
Nguyên tử của nguyên tố X có số hiệu nguyên tử Z và số khối A, được kí hiệu .
IV. Đồng vị
1. Định nghĩa: Các đồng vị của cùng một nguyên tố hoá học là những nguyên tử có cùng số
proton nhưng khác số nơtron, do đó số khối A của chúng khác nhau.
2. Nguyên tử khối và nguyên tử khối trung bình
• Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
• Giả sử nguyên tố A có hai đồng vị A1 và A2. Gọi là nguyên tử khối trung bình, A1 là nguyên tử khối của đồng vị A1, x1 là tỉ lệ phần trăm số nguyên tử của đồng vị A1; A2 là nguyên tử khối của đồng vị A2, x2 là tỉ lệ phần trăm số nguyên tử đồng vị A2.
Ta có:
Tổng quát:
V. Vỏ nguyên tử
1. Sự chuyển động của electron trong nguyên tử
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định nào. Vì chuyển động rất nhanh nên electron tạo thành quanh hạt nhân một vùng không gian mang điện âm gọi là mây electron hay obitan nguyên tử.
2. Obitan
Obitan nguyên tử là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90%. Obitan nguyên tử được kí hiệu là AO (Atomic Orbital).
3. Hình dạng obitan nguyên tử
Khi chuyển động trong nguyên tử, các electron có thể chiếm những mức năng lượng khác nhau đặc trưng cho trạng thái chuyển động của nó.
Những electron chuyển động gần hạt nhân hơn, chiếm những mức năng lượng thấp hơn tức là ở trạng thái bền hơn, những electron chuyển động ở xa hạt nhân có năng l




