Admin Yopo
Ban quản trị Team YOPO
- Tham gia
- 15/8/22
- Bài viết
- 6,066
- Điểm
- 48
tác giả
GIÁO ÁN MÔN HÓA 10 - BÀI 18. HYDROGEN HALIDE VÀ MỘT SỐ PHẢN ỨNG CỦA ION HALIDE được soạn dưới dạng file word/PDF/ powerpoint gồm 23 trang. Các bạn xem và tải về ở dưới.
3. Tìm hiểu tính acid của các hydrohalic acid
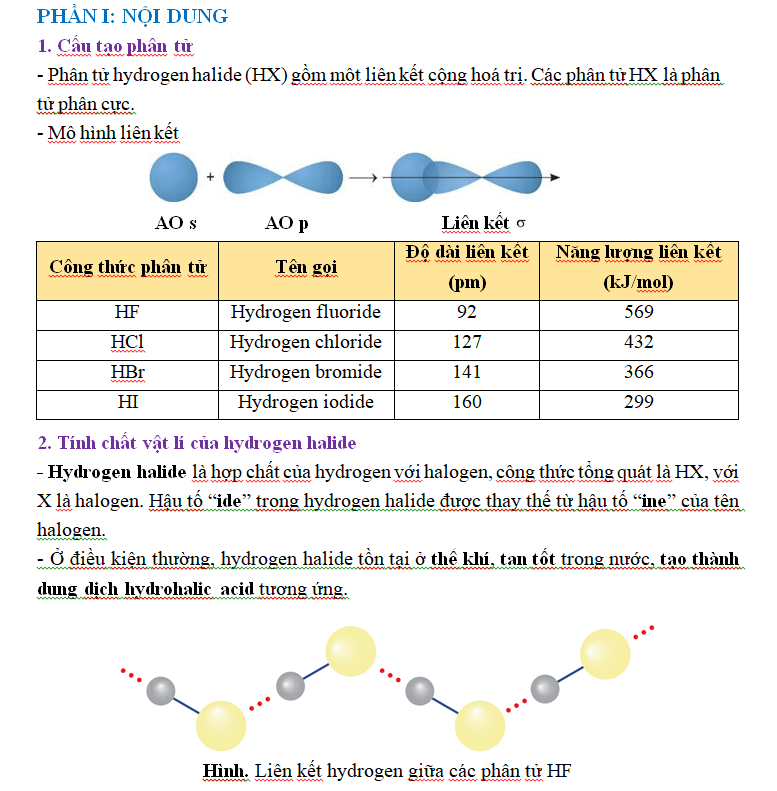
- Các hydrogen halide tan trong nước, tạo thành hydrohalic acid tương ứng.
- Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid.
- Hydrofluoric acid (HF) là acid yếu, nhưng có tính chất đặc biệt là ăn mòn thuỷ tinh, phương trình hoá học của phản ứng: SiO2 + 4HF → SiF4 + 2H2O
- Các dung dịch HCl, HBr, HI là những acid mạnh, có đầy đủ tính chất hoá học chung của acid:
+ Làm quỳ tím chuyển sang màu đỏ;
+ Tác dụng với kim loại đứng trước hydrogen trong dãy hoạt động hoá học;
+ Tác dụng với basic oxide, base và một số muối.
Minh họa phản ứng:
Fe + 2HCl → FeCl2 + H2
CuO + 2HCl → CuCl2 + H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
- Ngoài ra hydrohalic acid còn có tính khử, ví dụ: 2KMnO4 + 16HCl→ 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- Tính khử của các ion halide tăng theo chiều F– < Cl– < Br– < I– .
- Khi đun nóng các muối khan halide với chất oxi hoá mạnh, như dung dịch H2SO4 đặc, ion chloride không khử được H2SO4 đặc nên chỉ xảy ra phản ứng trao đổi.
3. Tìm hiểu tính acid của các hydrohalic acid
- Các hydrogen halide tan trong nước, tạo thành hydrohalic acid tương ứng.
- Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid.
- Hydrofluoric acid (HF) là acid yếu, nhưng có tính chất đặc biệt là ăn mòn thuỷ tinh, phương trình hoá học của phản ứng: SiO2 + 4HF → SiF4 + 2H2O
- Các dung dịch HCl, HBr, HI là những acid mạnh, có đầy đủ tính chất hoá học chung của acid:
+ Làm quỳ tím chuyển sang màu đỏ;
+ Tác dụng với kim loại đứng trước hydrogen trong dãy hoạt động hoá học;
+ Tác dụng với basic oxide, base và một số muối.
Minh họa phản ứng:
Fe + 2HCl → FeCl2 + H2
CuO + 2HCl → CuCl2 + H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
- Ngoài ra hydrohalic acid còn có tính khử, ví dụ: 2KMnO4 + 16HCl→ 2KCl + 2MnCl2 + 5Cl2 + 8H2O
4. Tính khử của các ion halide
- Trong ion halide, các halogen có số oxi hoá thấp nhất là -1, do đó ion halide chỉ thể hiện tính khử trong phản ứng oxi hoá - khử.- Tính khử của các ion halide tăng theo chiều F– < Cl– < Br– < I– .
- Khi đun nóng các muối khan halide với chất oxi hoá mạnh, như dung dịch H2SO4 đặc, ion chloride không khử được H2SO4 đặc nên chỉ xảy ra phản ứng trao đổi.





