- Tham gia
- 28/1/21
- Bài viết
- 86,007
- Điểm
- 113
tác giả
TÀI LIỆU CHUYÊN ĐỀ Bồi dưỡng học sinh giỏi hoá lớp 9 CÓ ĐÁP ÁN MỚI NHẤT được soạn dưới dạng file word gồm 140 trang. Các bạn xem và tải bồi dưỡng học sinh giỏi hoá lớp 9, chuyên đề học sinh giỏi hoá lớp 9 về ở dưới.
MỤC LỤC
CHUYÊN ĐỀ 1: DÃY HOẠT ĐỘNG HOÁ HỌC CỦA KIM LOẠI.
Ý nghĩa:
+ O2: nhiệt độ thường Ở nhiệt độ cao Khó phản ứng
Tác dụng với nước Không tác dụng với nước ở nhiệt độ thường
Tác dụng với các axit thông thường giải phóng Hidro Không tác dụng.
Kim loại đứng trước đẩy kim loại đứng sau ra khỏi muối
H2, CO không khử được oxit khử được oxit các kim loại này ở nhiệt độ cao
Chú ý:
Các kim loại đứng trước Mg phản ứng với nước ở nhiệt độ thường tạo thành dd Kiềm và giải phóng khí Hidro.
Trừ Au và Pt, các kim loại khác đều có thể tác dụng với HNO3 và H2SO4 đặc nhưng không giải phóng Hidro.
Trong các phương pháp giải các bài toán Hoá học phương pháp đại số cũng thường được sử dụng. Phương pháp này có ưu điểm tiết kiệm được thời gian, khi giải các bài toán tổng hợp, tương đối khó giải bằng các phương pháp khác. Phương pháp đại số được dùng để giải các bài toán Hoá học sau:
a. Giải bài toán lập CTHH bằng phương pháp đại số.
Thí dụ: Đốt cháy một hỗn hợp 300ml hiđrocacbon và amoniac trong oxi có dư. Sau khi cháy hoàn toàn, thể tích khí thu được là 1250ml. Sau khi làm ngưng tụ hơi nước, thể tích giảm còn 550ml. Sau khi cho tác dụng với dung dịch kiềm còn 250ml trong đó có 100ml nitơ. Thể tích của tất cả các khí đo trong điều kiện như nhau. Lập công thức của hiđrocacbon
4NH3 + 3O2 -> 2N2 + 6H2O (1)
CxHy + (x + O2 -> xCO2 + H2O (2)
Theo dữ kiện bài toán, sau khi đốt cháy amoniac thì tạo thành 100ml nitơ. Theo PTHH (1) sau khi đốt cháy hoàn toàn amoniac ta thu được thể tích nitơ nhỏ hơn 2 lần thể tích amoniac trong hỗn hợp ban đầu, vậy thể tích amonac khi chưa có phản ứng là 100. 2 = 200ml. Do đó thể tích hiđro cácbon khi chưa có phản ứng là 300 - 200 = 100ml. Sau khi đốt cháy hỗn hợp tạo thành (550 - 250) = 300ml, cacbonnic và (1250 - 550 - 300) = 400ml hơi nước.
Từ đó ta có sơ đồ phản ứng:
20 CHUYÊN ĐỀ BỒI DƯỠNG
HỌC SINH GIỎI MÔN HÓA LỚP 9
HỌC SINH GIỎI MÔN HÓA LỚP 9
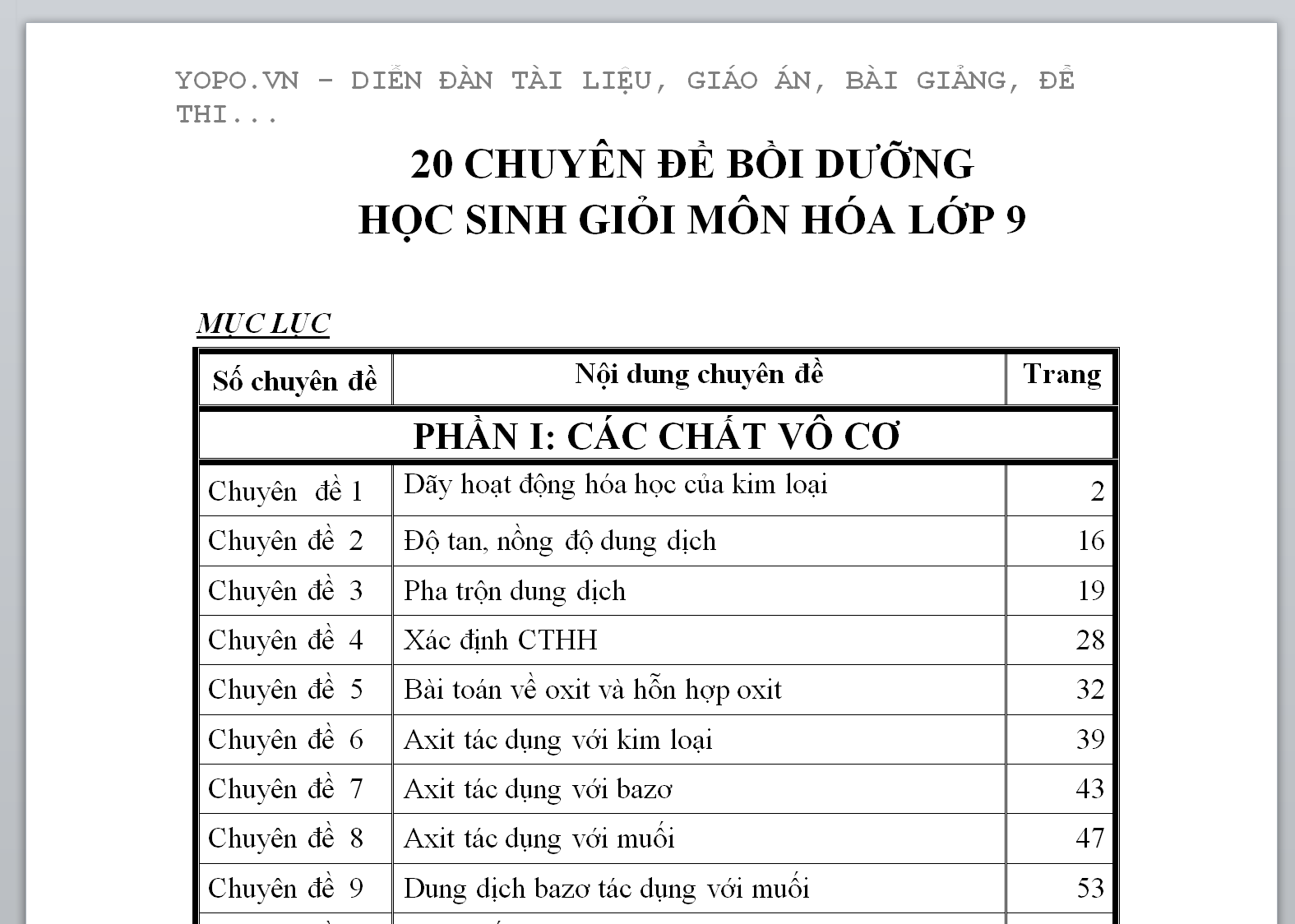
MỤC LỤC
Số chuyên đề | Nội dung chuyên đề | Trang |
PHẦN I: CÁC CHẤT VÔ CƠ | ||
| Chuyên đề 1 | Dãy hoạt động hóa học của kim loại | 2 |
| Chuyên đề 2 | Độ tan, nồng độ dung dịch | 16 |
| Chuyên đề 3 | Pha trộn dung dịch | 19 |
| Chuyên đề 4 | Xác định CTHH | 28 |
| Chuyên đề 5 | Bài toán về oxit và hỗn hợp oxit | 32 |
| Chuyên đề 6 | Axit tác dụng với kim loại | 39 |
| Chuyên đề 7 | Axit tác dụng với bazơ | 43 |
| Chuyên đề 8 | Axit tác dụng với muối | 47 |
| Chuyên đề 9 | Dung dịch bazơ tác dụng với muối | 53 |
| Chuyên đề 10 | Hai muối tác dụng với nhau | 55 |
| Chuyên đề 11 | Bài toán hỗn hợp kim loại | 58 |
| Chuyên đề 12 | Bài toán hỗn hợp muối | 74 |
| Chuyên đề 13 | Bài tập tỏng hợp và tính theo PTHH | 86 |
| Chuyên đề 14 | Nhận biết – Phân biệt các chất | 100 |
| Chuyên đề 15 | Tách – Tinh chế các chất | 103 |
| Chuyên đề 16 | Viết PTHH điều chế các chất vô cơ và thực hiện sơ đồ chuyển hóa | 104 |
PHẦN II: CÁC CHẤT HỮU CƠ | ||
| Chuyên đề 17 | Viết đồng phân CTCT, Viết PTHH theo chuỗi phản ứng – Điều chế, nhận biết – Phân biệt – Tách các chất hữu cơ. | 113 |
| Chuyên đề 18 | Toán Hidrocacbon | 117 |
| Chuyên đề 19 | Tính chất – Điều chế Ancol | 131 |
| Chuyên đề 20 | Tính chất, điều chế Axit và Este | 137 |
CHUYÊN ĐỀ 1: DÃY HOẠT ĐỘNG HOÁ HỌC CỦA KIM LOẠI.
Ý nghĩa:
K | Ba | Ca | Na | Mg | Al | Zn | Fe | Ni | Sn | Pb | H | Cu | Ag | Hg | Au | Pt |
K | Ba | Ca | Na | Mg | Al | Zn | Fe | Ni | Sn | Pb | H | Cu | Ag | Hg | Au | Pt |
Tác dụng với nước Không tác dụng với nước ở nhiệt độ thường
K | Ba | Ca | Na | Mg | Al | Zn | Fe | Ni | Sn | Pb | H | Cu | Ag | Hg | Au | Pt |
K | Ba | Ca | Na | Mg | Al | Zn | Fe | Ni | Sn | Pb | H | Cu | Ag | Hg | Au | Pt |
Kim loại đứng trước đẩy kim loại đứng sau ra khỏi muối
K | Ba | Ca | Na | Mg | Al | Zn | Fe | Ni | Sn | Pb | H | Cu | Ag | Hg | Au | Pt |
H2, CO không khử được oxit khử được oxit các kim loại này ở nhiệt độ cao
Chú ý:
Các kim loại đứng trước Mg phản ứng với nước ở nhiệt độ thường tạo thành dd Kiềm và giải phóng khí Hidro.
Trừ Au và Pt, các kim loại khác đều có thể tác dụng với HNO3 và H2SO4 đặc nhưng không giải phóng Hidro.
1. PHƯƠNG PHÁP ĐẠI SỐ
Trong các phương pháp giải các bài toán Hoá học phương pháp đại số cũng thường được sử dụng. Phương pháp này có ưu điểm tiết kiệm được thời gian, khi giải các bài toán tổng hợp, tương đối khó giải bằng các phương pháp khác. Phương pháp đại số được dùng để giải các bài toán Hoá học sau:
a. Giải bài toán lập CTHH bằng phương pháp đại số.
Thí dụ: Đốt cháy một hỗn hợp 300ml hiđrocacbon và amoniac trong oxi có dư. Sau khi cháy hoàn toàn, thể tích khí thu được là 1250ml. Sau khi làm ngưng tụ hơi nước, thể tích giảm còn 550ml. Sau khi cho tác dụng với dung dịch kiềm còn 250ml trong đó có 100ml nitơ. Thể tích của tất cả các khí đo trong điều kiện như nhau. Lập công thức của hiđrocacbon
Bài giải
Khi đốt cháy hỗn hợp hiđrocacbon và amoniac trong oxi phản ứng xảy ra theo phương trình sau:4NH3 + 3O2 -> 2N2 + 6H2O (1)
CxHy + (x + O2 -> xCO2 + H2O (2)
Theo dữ kiện bài toán, sau khi đốt cháy amoniac thì tạo thành 100ml nitơ. Theo PTHH (1) sau khi đốt cháy hoàn toàn amoniac ta thu được thể tích nitơ nhỏ hơn 2 lần thể tích amoniac trong hỗn hợp ban đầu, vậy thể tích amonac khi chưa có phản ứng là 100. 2 = 200ml. Do đó thể tích hiđro cácbon khi chưa có phản ứng là 300 - 200 = 100ml. Sau khi đốt cháy hỗn hợp tạo thành (550 - 250) = 300ml, cacbonnic và (1250 - 550 - 300) = 400ml hơi nước.
Từ đó ta có sơ đồ phản ứng:




