- Tham gia
- 28/1/21
- Bài viết
- 86,007
- Điểm
- 113
tác giả
Đề cương ôn tập học kì 1 môn hóa 9 TUYỂN CHỌN đề cương ôn tập học kì 1 hóa 9 CÓ ĐÁP ÁN RẤT HAY
YOPO xin giới thiệu với các bạn đề cương ôn tập học kì I môn Hóa học lớp 9 để tham khảo và củng cố thêm kiến thức chuẩn bị cho kì thi cuối kì sắp tới đây ...Đề ôn tập học kì 1 môn hoá lớp 9 có đáp án và lời giải chi tiết bám sát cấu trúc của các trường, phòng, sở giáo dục trên cả nước.
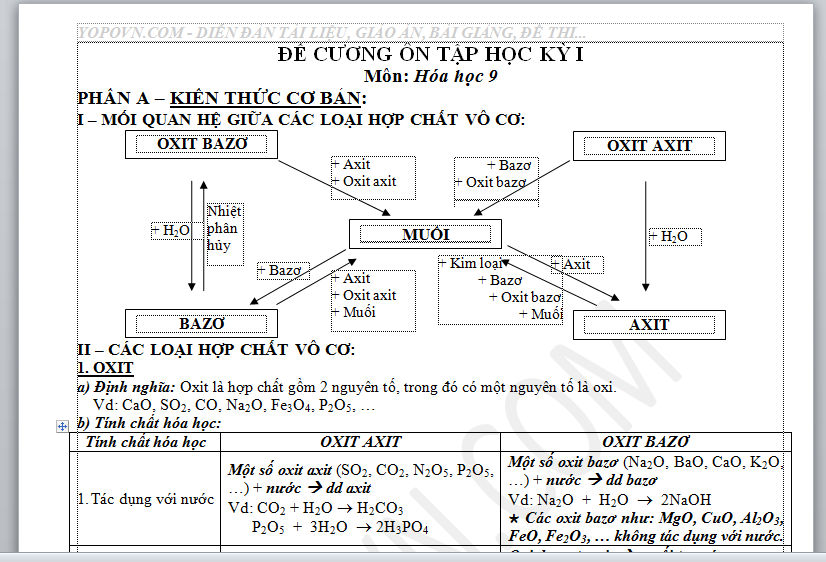
PHẦN A – KIẾN THỨC CƠ BẢN:
I – MỐI QUAN HỆ GIỮA CÁC LOẠI HỢP CHẤT VÔ CƠ:
II – CÁC LOẠI HỢP CHẤT VÔ CƠ:
1. OXIT
a) Định nghĩa: Oxit là hợp chất gồm 2 nguyên tố, trong đó có một nguyên tố là oxi.
Vd: CaO, SO2, CO, Na2O, Fe3O4, P2O5, …
b) Tính chất hóa học:
2. AXIT
a) Định nghĩa: Axit là hợp chất mà phân tử gồm có một hay nhiều nguyên tử H liên kết với gốc axit. Các nguyên tử H này có thể thay thế bằng các ng/tử kim loại.
Vd: HCl, HNO3, H2SO4, H3PO4, …
b) Tính chất hóa học:
Ø Sản xuất axit sunfuric: Gồm các công đoạn sau:
(1) S + O2 SO2
(2) 2SO2 + O2 2SO3
V2O5
(3) SO3 + H2O ® H2SO4
3. BAZƠ
a) Định nghĩa: Bazơ là hợp chất mà phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (OH).
Vd: KOH, NaOH, Ba(OH)2, Al(OH)3, …
b) Tính chất hóa học:
Ø Sản xuất natri hiđroxit:
2NaCl + H2O 2NaOH + Cl2 + H2
c) Thang pH: Dùng để biểu thị độ axit hoặc độ bazơ của một dung dịch:
pH = 7: trung tính ; pH < 7: tính axit ; pH > 7: tính bazơ
4. MUỐI
a) Định nghĩa: Muối là hợp chất mà phân tử có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit. Vd: NaCl, MgSO4, Fe(NO3)2, BaCO3, …
b) Tính chất hóa học:
c) Phản ứng trao đổi:
Định nghĩa: Là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
Vd: BaCl2 + H2SO4 ® BaSO4 + 2HCl
Na2CO3 + 2HCl ® 2NaCl + H2O + CO2
CuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4
NaCl + AgNO3 ® AgCl + NaNO3
Điều kiện để phản ứng trao đổi xảy ra: Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Ø Lưu ý: Phản ứng trung hòa cũng là phản ứng trao đổi và luôn xảy ra.
Vd: NaOH + HCl ® NaCl + H2O
III – KIM LOẠI:
1. TÍNH CHẤT CHUNG CỦA KIM LOẠI
XEM THÊM:
YOPO xin giới thiệu với các bạn đề cương ôn tập học kì I môn Hóa học lớp 9 để tham khảo và củng cố thêm kiến thức chuẩn bị cho kì thi cuối kì sắp tới đây ...Đề ôn tập học kì 1 môn hoá lớp 9 có đáp án và lời giải chi tiết bám sát cấu trúc của các trường, phòng, sở giáo dục trên cả nước.
ĐỀ CƯƠNG ÔN TẬP HỌC KỲ I
Môn: Hóa học 9
Môn: Hóa học 9
PHẦN A – KIẾN THỨC CƠ BẢN:
I – MỐI QUAN HỆ GIỮA CÁC LOẠI HỢP CHẤT VÔ CƠ:
II – CÁC LOẠI HỢP CHẤT VÔ CƠ:
1. OXIT
a) Định nghĩa: Oxit là hợp chất gồm 2 nguyên tố, trong đó có một nguyên tố là oxi.
Vd: CaO, SO2, CO, Na2O, Fe3O4, P2O5, …
b) Tính chất hóa học:
Tính chất hóa học | OXIT AXIT | OXIT BAZƠ |
| Tác dụng với nước | Một số oxit axit (SO2, CO2, N2O5, P2O5, …) + nước à dd axit Vd: CO2 + H2O ® H2CO3 P2O5 + 3H2O ® 2H3PO4 | Một số oxit bazơ (Na2O, BaO, CaO, K2O, …) + nước à dd bazơ Vd: Na2O + H2O ® 2NaOH Ø Các oxit bazơ như: MgO, CuO, Al2O3, FeO, Fe2O3, … không tác dụng với nước. |
| Tác dụng với axit | < Không phản ứng > | Oxit bazơ + axit à muối + nước Vd: CuO + 2HCl ® CuCl2 + H2O CaO + H2SO4 ® CaSO4 + H2O |
| Tác dụng với dd bazơ (kiềm) | Oxit axit + dd bazơ à muối + nước Vd: SO2 + Ca(OH)2 ® CaSO3 + H2O CO2 + Ba(OH)2® BaCO3 + H2O | < Không phản ứng > |
| Tác dụng với oxit axit | < Không phản ứng > | Oxit bazơ + oxit axit à muối Vd: CaO + CO2 ® CaCO3 |
| Tác dụng với oxit bazơ | Oxit axit + oxit bazơ à muối Vd: SO2 + BaO ® BaSO3 | < Không phản ứng > |
a) Định nghĩa: Axit là hợp chất mà phân tử gồm có một hay nhiều nguyên tử H liên kết với gốc axit. Các nguyên tử H này có thể thay thế bằng các ng/tử kim loại.
Vd: HCl, HNO3, H2SO4, H3PO4, …
b) Tính chất hóa học:
| Tác dụng với chất chỉ thị: Dd axit làm giấy quỳ tím chuyển sang màu đỏ. Tác dụng với kim loại: Một số dd axit (HCl, H2SO4 loãng) + các kim loại đứng trước H (trong dãy HĐHH của kim loại) à muối + H2 Vd: 2Al + 3H2SO4loãng ® Al2(SO4)3 +3H2 Zn + 2HCl ® ZnCl2 + H2 Ø H2SO4 đặc và HNO3 tác dụng với hầu hết các kim loại tạo muối nhưng không giải phóng khí H2. Vd: Cu + 2H2SO4đặc ® CuSO4 + SO2 + 2H2O Ø H2SO4 đặc có tính háo nước. | Tác dụng với oxit bazơ: Axit + oxit bazơ à muối + nước Vd: CaO + H2SO4 ® CaSO4 + H2O Tác dụng với bazơ: Axit + bazơ à muối + nước (phản ứng trung hòa) Vd: 2Fe(OH)3 + 3H2SO4 ® Fe2(SO4)3 + 6H2O Tác dụng với muối: Axit + muối à muối mới + axit mới Vd: H2SO4 + BaCl2 ® BaSO4 + 2HCl 2HCl + Na2CO3 ® 2NaCl + H2O + CO2 Ø Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan hoặc chất khí. |
Ø Sản xuất axit sunfuric: Gồm các công đoạn sau:
(1) S + O2 SO2
(2) 2SO2 + O2 2SO3
V2O5
3. BAZƠ
a) Định nghĩa: Bazơ là hợp chất mà phân tử gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (OH).
Vd: KOH, NaOH, Ba(OH)2, Al(OH)3, …
b) Tính chất hóa học:
| Tác dụng với chất chỉ thị: Dd bazơ làm giấy quỳ tím chuyển sang màu xanh, dd phenolphtalein chuyển sang màu đỏ. Tác dụng với oxit axit: Dd bazơ + oxit axit à muối + nước Vd: Ca(OH)2 + SO3 ® CaSO4 + H2O Tác dụng với axit: Bazơ + axit à muối + nước (phản ứng trung hòa) Vd: NaOH + HCl ® NaCl + H2O | Tác dụng với muối: Dd bazơ + dd muối à muối mới + bazơ mới Vd: Ba(OH)2 + CuSO4 ® BaSO4 + Cu(OH)2 3NaOH + FeCl3 ® Fe(OH)3 + 3NaCl Ø Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan.
Vd: Cu(OH)2 ® CuO + H2O |
|
2NaCl + H2O 2NaOH + Cl2 + H2
c) Thang pH: Dùng để biểu thị độ axit hoặc độ bazơ của một dung dịch:
pH = 7: trung tính ; pH < 7: tính axit ; pH > 7: tính bazơ
4. MUỐI
a) Định nghĩa: Muối là hợp chất mà phân tử có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit. Vd: NaCl, MgSO4, Fe(NO3)2, BaCO3, …
b) Tính chất hóa học:
| 1. Tác dụng với kim loại: Muối + kim loại à muối mới + kim loại mới Vd: Fe + CuSO4 ® FeSO4 + Cu Cu + 2AgNO3 ® Cu(NO3)2 + 2Ag Ø Lưu ý: Kim loại đứng trước (trừ K, Na, Ca, …) đẩy kim loại đứng sau (trong dãy HĐHH của kim loại) ra khỏi dung dịch muối của chúng. 2. Tác dụng với axit: Muối + axit à muối mới + axit mới Vd: BaCl2 + H2SO4 ® BaSO4 + 2HCl Na2CO3 + 2HCl ® 2NaCl + H2O + CO2 Ø Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan hoặc chất khí. | 3. Tác dụng với bazơ: Dd muối + dd bazơ à muối mới + bazơ mới Vd: CuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4 Ø Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan. 4. Tác dụng với muối: Muối + muối à 2 muối mới Vd: NaCl + AgNO3 ® AgCl + NaNO3 Ø Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan. 5. Phản ứng nhiệt phân hủy:
Vd: CaCO3 ® CaO + CO2 |
Định nghĩa: Là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
Vd: BaCl2 + H2SO4 ® BaSO4 + 2HCl
Na2CO3 + 2HCl ® 2NaCl + H2O + CO2
CuSO4 + 2NaOH ® Cu(OH)2 + Na2SO4
NaCl + AgNO3 ® AgCl + NaNO3
Điều kiện để phản ứng trao đổi xảy ra: Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Ø Lưu ý: Phản ứng trung hòa cũng là phản ứng trao đổi và luôn xảy ra.
Vd: NaOH + HCl ® NaCl + H2O
III – KIM LOẠI:
1. TÍNH CHẤT CHUNG CỦA KIM LOẠI
XEM THÊM:
- Giáo án hóa 9 theo công văn 5512 MỚI NHẤT FULL NĂM 2021 - 2022
- Tài Liệu Bồi dưỡng học sinh giỏi hóa 9 cao cự giác pdf - YopoVn ...
- TOP 15+ TÀI LIỆU, sách bồi dưỡng học sinh giỏi hóa 9 NĂM 2021 ...
- 300+ CÁC CHUYÊN ĐỀ ÔN THI HSG HÓA 9 NĂM 2021 - 2022 ...
- 400 BÀI TẬP các chuyên đề bồi dưỡng hsg hóa 9 pdf NĂM 2021 ...
- Sách bồi dưỡng học sinh giỏi hóa 9 pdf - luyện thi chuyên hóa lớp ...
- 500+ ĐỀ THI HSG HÓA LỚP 9 CẤP TỈNH NĂM 2021 - 2022 MỚI ...
- TOP 3++ Đề thi giữa kì 1 hóa 9 trắc nghiệm có đáp án NĂM 2021 ...
- LIST 3++ ĐỀ THI HK1 HÓA 9 TRẮC NGHIỆM NĂM 2021 - 2022 MỚI ...
- Giáo Án Môn Hóa 9 Theo Công Văn 5512 Học Kỳ 1 MỚI NHẤT ...
- CHUYÊN ĐỀ giảng dạy và bồi dưỡng HSG môn hóa học 9 : Bài tập ...
- Giáo Án Hóa 9 Theo Công Văn 5512 Học Kỳ 2 MỚI NHẤT - YopoVn ...
- Hóa học lớp 9 | YopoVn.Com - DIỄN ĐÀN TÀI LIỆU - GIÁO ÁN
- TOPVN 50++ ĐỀ THI HỌC SINH GIỎI MÔN HÓA LỚP 9 NĂM 2022 ...
- 200+ ĐỀ THI HỌC SINH GIỎI HÓA HỌC LỚP 9 QUA CÁC NĂM ...




