Kiến thức hóa lớp 11 học kì 2 TỔNG HỢP TÓM TẮT hệ thông kiến thức hóa lớp 11 học kì 2 RẤT CHI TIẾT
YOPOVN xin gửi đến quý thầy cô, các em học sinh Kiến thức hóa lớp 11 học kì 2 TỔNG HỢP TÓM TẮT hệ thông kiến thức hóa lớp 11 học kì 2 RẤT CHI TIẾT. Đây là bộ Kiến thức hóa lớp 11 học kì 2, kiến thức hóa lớp 11 học kì 2, tổng hợp kiến thức hóa 11 học kì 2, hệ thông kiến thức hóa lớp 11 học kì 2....
Tổng hợp kiến thức Hóa 11 học kì 2
Tổng hợp kiến thức Hóa 11 học kì 1
Tổng hợp kiến thức Hóa 11 PDF
Tổng hợp kiến thức hóa 11 nâng cao
Chương trình hóa 11 học kì 2
Sơ đồ tư duy Hóa 11 học kì 2
File công thức Hóa 11
Tài liệu ôn tập Hóa 11 học kì 2
Tổng hợp kiến thức Hóa 11 học kì 2
Tổng hợp kiến thức Hóa 11 học kì 1
Sơ đồ tư duy Hóa 11 học kì 2
Tổng hợp kiến thức hóa 11 nâng cao
Tổng hợp kiến thức Hóa 11 PDF
Chương trình hóa 11 học kì 2
Tài liệu ôn tập Hóa 11 học kì 2
File công thức Hóa 11
Tổng hợp kiến thức Hóa 11 học kì 2
Tổng hợp kiến thức Hóa 11 học kì 1
Sơ đồ tư duy Hóa 11 học kì 2
Tổng hợp kiến thức hóa 11 nâng cao
Tổng hợp kiến thức Hóa 11 PDF
Chương trình hóa 11 học kì 2
Tài liệu ôn tập Hóa 11 học kì 2
File công thức Hóa 11
I. Khái niệm - Đồng đẳng - Đồng phân - Danh pháp
1. Khái niệm: Ankan là hidrocacbon no mạch hở có CTTQ CnH2n+2 (n ≥ 1).
2. Đồng phân: Từ C4H10 trở đi có đồng phân cấu tạo (đồng phân mạch C).
C5H10 có ba đồng phân: CH3-CH2-CH2-CH2CH3; CH3-CH(CH3)-CH2-CH3; CH3-C(CH3)2-CH3
3. Danh pháp
- Nắm tên các ankan mạch không nhánh từ C1 → C10
- Danh pháp IUPAC: Số chỉ vị trí nhánh + tên nhánh + tên mạch C chính + an
Thí dụ: (2-metylbutan)
- Bậc của nguyên tử C trong hiđrocacbon no được tính bằng số liên kết của nó với các nguyên tử C khác.
Thí dụ:
II. Tính chất vật lý
- Từ CH4 → C4H10 là chất khí. - Từ C5H12 → C17H36 là chất lỏng. - Từ C18H38 trở đi là chất rắn.
III. Tính chất hóa học
1. Phản ứng thế bởi halogen (đặc trưng cho hidrocacbon no)
Nhận xét: Nguyên tử H liên kết với nguyên tử C bậc cao hơn dể bị thế hơn nguyên tử H liên kết với nguyên tử C bậc thấp hơn.
2. Phản ứng tách.
- Tách H:
- Crackinh:
3. Phản ứng oxi hóa.
Nhận xét: > nankan = nH2O - nCO2
IV. Điều chế
a. Phòng thí nghiệm:
- RCOONa + NaOH R-H + Na2CO3
Thí dụ: CH3COONa + NaOH CH4↑ + Na2CO3
- Al4C3 + 12H2O → 3CH4↑ + 4Al(OH)3
b. Trong công nghiệp: Đi từ khí thiên nhiên, khí mỏ dầu và từ dầu mỏ.
I. Khái niệm - Đồng phân - Danh pháp
1. Khái niệm:
- Anken là hidrocacbon không no mạch hở có một nối đôi trong phân tử.
- CTTQ là CnH2n (n)
2. Đồng phân: Có hai loại đồng phân
- Đồng phân cấu tạo: (Đồng phân mạch C và đồng phân vị trí liên kết đôi)
Thí dụ: C4H8 (3 đp cấu tạo) CH2=CH-CH2-CH3; CH3-CH=CH-CH3; CH2=C(CH3)-CH3
- Đồng phân hình học (cis - trans):
Thí dụ: CH3-CH=CH-CH3 có hai đồng phân hình học
3. Danh pháp:
- Danh pháp thường: Tên ankan nhưng thay đuôi an = ilen.
Thí dụ: C2H4 (etilen), C3H6 (propilen)
- Danh pháp IUPAC:
(C4H8) But-2-en (C4H8) 2 - Metylprop-1-en
II. Tính chất vật lý
Ở điều kiện thường thì : - Từ C2H4 → C4H8 là chất khí. - Từ C5H10 trở đi là chất lỏng hoặc chất rắn.
III. Tính chất hóa học
1. Phản ứng cộng (đặc trưng)
* Cộng H2: CnH2n + H2 CnH2n+2
* Cộng Halogen: CnH2n + X2 CnH2nX2
Phản ứng anken tác dụng với Br2 dùng để nhận biết anken (dung dịch Br2 mất màu)
* Cộng HX (X: Cl, Br, OH . . .)
Thí dụ: CH2=CH2 + HOH CH3-CH2OH
CH2=CH2 + HBr CH3-CH2Br
- Các anken có cấu tạo phân tử không đối xứng khi cộng HX có thể cho hỗn hợp hai sản phẩm
- Quy tắc Maccopnhicop: Trong phản ứng cộng HX vào liên kết đôi, nguyên tử H (phần mang điện dương) chủ yếu cộng vào nguyên tử C bậc thấp hơn (có nhiều H hơn), còn nguyên hay nhóm nguyên tử X (phần mang điện âm) cộng vào nguyên tử C bậc cao hơn (ít H hơn).
2. Phản ứng trùng hợp:
3. Phản ứng oxi hóa:
- Oxi hóa hoàn toàn: CnH2n + 3n/2O2 nCO2 + nH2O (=)
- Oxi hóa không hoàn toàn: Anken có thể làm mất màu dung dịch thuốc tím.
4. Điều chế
a. Phòng thí nghiệm: CnH2n+1OH CnH2n + H2O
b. Điều chế từ ankan: CnH2n+2 CnH2n + H2
I. Định nghĩa - Phân loại - Danh pháp
1. Định nghĩa: Là hidrocacbon không no mạch hở, trong phân tử chứa hai liên kết C=C, có CTTQ CnH2n-2
- Ví dụ: CH2=C=CH2, CH2=CH-CH=CH2 . . .
2. Phân loại: Có ba loại:
- Ankadien có hai liên kết đôi liên tiếp.
- Ankadien có hai liên kết đôi cách nhau bởi một liên kết đơn (ankadien liên hợp).
- Ankadien có hai liên kết đôi cách nhau từ hai liên kết đơn trở lên.
3. Danh pháp:
II. Tính chất hóa học
1. Phản ứng cộng (H2, X2, HX)
* Cộng H2: CH2=CH-CH=CH2 + 2H2 CH3-CH2-CH2-CH3
* Cộng brom, HX:
Cộng 1:2 CH2=CH-CH=CH2 + Br2 (dd) CH2=CH-CHBr-CH2Br (spc)
Cộng 1:4 CH2=CH-CH=CH2 + Br2 (dd) CH2Br-CH=CH-CH2Br (spc)
Cộng đồng thời vào hai liên kết đôi
CH2=CH-CH=CH2 + 2Br2 (dd) CH2Br-CHBr-CHBr-CH2Br
* Cộng HX
Cộng 1:2 CH2=CH-CH=CH2 + HBr CH2=CH-CHBr-CH3 (spc)
Cộng 1:4 CH2=CH-CH=CH2 + HBr CH2=CH-CH2-CH2Br (spc)
2. Phản ứng trùng hợp:
- VD:
Cao su buna
3. Phản ứng oxi hóa:
- Oxi hóa hoàn toàn: 2C4H6 + 11O2 8CO2 + 6H2O
- Oxi hóa không hoàn toàn: Tương tự như anken thì ankadien có thể làm mất màu dung dịch thuốc tím. Phản ứng này dùng để nhận biết ankadien.
III. Điều chế
- Được điều chế từ ankan tương ứng bằng phản ứng tách H2.
I. Khái niệm - Đồng phân - Danh pháp
1. Khái niệm: Là hidrocacbon không no mạch hở trong phân tử có một liên kết ba .
CTTQ là CnH2n-2 (n2).
2. Đồng phân
- Chỉ có đồng phân cấu tạo (đồng phân mạch C và đồng phân vị trí liên kết ).
Thí dụ: C4H6 có hai đồng phân CH≡C-CH2-CH3; CH3-C≡C-CH3.
3. Danh pháp:
- Danh pháp thường: Tên gốc ankyl + axetilen
Thí dụ: C2H2 (axetilen), CH≡C-CH3 (metylaxetilen)
- Danh pháp IUPAC:
But-1-in But-2-in
II. Tính chất hóa học
1. Phản ứng cộng (H2, X2, HX, phản ứng đime hóa và trime hóa).
+ Cộng H2
Nếu dùng xúc tác Pd/PbCO3 hoặc Pd/BaSO4, ankin chỉ cộng một phân tử H2 tạo anken
+ Cộng X2 (Ankin làm mất màu dung dịch Brom tương tự anken, ankadien)
+ Cộng HX (Tuân theo quy tắc Mac-côp-nhi-cốp)
+ Phản ứng đime hóa - trime hóa
2. Phản ứng thế bằng ion kim loại
*Điều kiện: Phải có liên kết 3 ở đầu mạch.
* Phản ứng này dùng để nhận biết Ank-1-in
3. Phản ứng oxi hóa:
- Oxi hóa hoàn toàn: CnH2n-2 + (3n-1)/2 O2 → nCO2 + (n-1)H2O ()
- Oxi hóa không hoàn toàn: Tương tự như anken và ankadien, ankin cũng có khả năng làm mất màu dung dịch thuốc tím. Phản ứng này dùng để nhận biết ankin.
III. Điều chế:
a. Phòng thí nghiệm: CaC2 + 2H2O → C2H2↑ + Ca(OH)2
b. Trong công nghiệp: 2CH4 C2H2 + 3H2
I. Đồng đẳng - Đồng phân - Danh pháp
1. Đồng đẳng: Dãy đồng đẵng của benzen có CTTQ là CnH2n-6 (n ≥ 6)
2. Đồng phân:
- Đồng phân về vị trí tương đối của các nhóm ankyl xung quanh vòng benzen (o, m, p).
- Đồng phân mạch C
3. Danh pháp: Gọi tên theo danh pháp hệ thống.
Ví dụ: C6H5CH3 metylbenzen (toluen) C6H5C2H5 etylbenzen
II. Tính chât hóa học:
1. Phản ứng thế:
* Thế nguyên tử H ở vòng benzen
- Tác dụng với halogen: C6H6 + Br2 C6H5Br + HBr
Cho ankyl benzen phản ứng với brom có xúc tác bột Fe thì thu được hỗn hợp sản phẩm thế brom chủ yếu vào vị trí ortho và para.
o-bromtoluen
p-bromtoluen
- Phản ứng giữa benzen và đồng đẳng với axit HNO3 xãy ra tương tự như phản ứng với halogen.
- Quy tắc thế H ở vòng benzen: Các ankyl benzen dể tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
* Thế nguyên tử H ở gốc ankyl
2. Phản ứng cộng (H2 và Cl2)
- Oxi hóa không hoàn toàn: Ankyl benzen có khả năng làm mất màu dung dịch thuốc tím đun nóng.
- Phản ứng oxi hóa hoàn toàn:
III. STIREN:
1. Cấu tạo: CTPT: C8H8; CTCT:
2. Tính chất hóa học:
a. Tính chất của anken
- Stiren làm mất màu dung dịch Br2 (Dùng để nhận biết stiren): C6H5CH=CH2 + Br2 → C6H5CHBr-CH2Br
- Phản ứng với H2
c. Phản ứng oxi hóa
Stiren phản ứng dung dịch KMnO4 ở điều kiện thường (oxi hóa liên kết đôi C=C); đun nóng (oxi hóa nhóm –CH=CH2).
I. Định nghĩa
- Ancol là những hợp chất hữu cơ trong phân tử có nhóm OH liên kết trực tiếp với nguyên tử C no.
- Bậc ancol là bậc của nguyên tử C liên kết trực tiếp với nhóm OH.
Thí dụ
CH3-CH2-CH2-CH2OH: ancol bậc I CH3-CH2-CH(CH3)-OH: ancol bậc II
CH3-C(CH3)2-OH:ancol bậc III
II. Đồng phân - Danh pháp
1. Đồng phân: Chỉ có đồng phân cấu tạo (gồm đồng phân mạch C và đồng phân vị trí nhóm OH).
- Thí dụ: C4H10O có 4 đồng phân ancol
CH3-CH2-CH2-CH2OH CH3-CH(CH3)-CH2OH CH3-CH2-CH(CH3)-OH CH3-C(CH3)2-OH
2. Danh pháp:
- Danh pháp thường: Ancol + tên gốc ankyl + ic
+ Ví dụ: C2H5OH (ancol etylic)
- Danh pháp thay thế: Tên hidrocacbon tương ứng với mạch chính + số chỉ vị trí nhóm OH + ol
+ Ví dụ: (3-metylbutan-1-ol)
III. Tính chất vật lý
- Tan nhiều trong nước do tạo được liên kết H với nước. Độ tan trong nước giảm dần khi số nguyên tử C tăng lên .
- Nhiệt đô sôi cao hơn so với hidrocacbon cùng CTPT hoặc đồng phần ete (do liên kết hidro giữa các phân tử ancol)
IV. Tính chất hóa học
1. Phản ứng thế H của nhóm OH
* Tính chất chung của ancol
* Tính chất đặc trưng của ancol đa chức có hai nhóm OH liền kề
- Hòa tan được Cu(OH)2 ở điều kiện thường tạo thành dung dịch màu xanh lam. Phản ứng này dùng để nhận biết ancol đa chức có hai nhóm OH liền kề.
2. Phản ứng thế nhóm OH
* Phản ứng với axit vô cơ C2H5 - OH + H - Br C2H5Br + H2O
* Phản ứng với ancol
- TQ: 2ROH R-O-R + H2O
3. Phản ứng tách nước
- TQ: CnH2n+1OH CnH2n + H2O
4. Phản ứng oxi hóa:
- Oxi hóa không hoàn toàn:
+ Ancol bậc 1 khi bị oxi hóa bởi CuO/to cho ra sản phẩm là andehit
+ Ancol bậc hai khi bị oxi hóa bởi CuO/to cho ra sản phẩm là xeton.
+ Ancol bậc III khó bị oxi hóa.
- Oxi hóa hoàn toàn: CnH2n+1OH + 3n/2O2 nCO2 + (n+1)H2O
V. Điều chế:
a. Phương pháp tổng hợp:
Điều chế từ anken tương ứng: CnH2n + H2O CnH2n+1OH
b. Phương pháp sinh hóa: Điều chế C2H5OH từ tinh bột.
1. Định nghĩa: Phenol là những hợp chất hữu cơ trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử C vòng benzen.
- Ví dụ: C6H5OH (phenol) . . .
2. Tính chất vật lý
- Đk thường là chất rắn; ít tan trong nước lạnh, tan nhiều trong nước nóng.
- Rất độc, dây vào tay gây bỏng nặng.
3. Tính chất hóa học
a. Phản ứng thế nguyên tử H của nhóm OH
- Tác dụng với kim loại kiềm
- Tác dụng với dung dịch bazơ
b. Phản ứng thế H của vòng benzen
- Tác dụng với dung dịch Brom
- Tác dụng với dung dịch HNO3
Chú ý: Hai phản ứng trên dùng để nhận biết phenol.
I. Định nghĩa, phân loại, danh pháp:
1. Định nghĩa: Anđehit là những HCHC trong phân tử có nhóm CHO (nhóm cacbonyl) liên kết trực tiếp với nguyên tử cacbon (1) hoặc nguyên tử hiđro.
2. Phân loại:
- Có nhiều cách phân loại: (sgk)
- Anđehit no, đơn chức, mạch hở có công thức chung là : CnH2n + 1CHO (với n ³ 0) hoặc CnH2n O (với n ³ 1).
3. Danh pháp:
a) Tên thông thường: Tên gọi = anđehit + tên axit tương ứng.
Ví dụ: H – CHO : anđehit fomic CH3 – CHO: anđehit axetic. C6H5 – CHO: anđehit benzoic
b) Tên thay thế: Tên gọi = tên hiđrocacbon tương ứng mạch chính + al
Ví dụ: HCHO : metanal CH3CHO : etanal CH3CH2CHO : propanal
II. Tính chất hoá học:
1. Tính oxi hóa
* Phản ứng cộng với hiđro:
Tổng quát: R-CHO + H2 R – CH2OH
+ Trong phản ứng trên R–CHO đóng vai trò chất oxi hoá.
2. Tính khử
a) Phản ứng với dung dịch AgNO3/NH3 (Phản ứng tráng bạc)
* Chú ý: Phản ứng tác dụng với dung dịch AgNO3 /NH3 dùng để nhận biết anđehit.
b) Phản ứng với oxi: 2RCHO + O2 2RCOOH
c) Phản ứng với dung dịch nước Br2
* Andehit làm mất màu dung dịch Brom và dung dịch KMnO4
III. Điều chế:
1. Từ ancol: Oxi hoá ancol bậc I ® anđehit R – CH2OH + CuO R – CHO + H2O + Cu
2 . Từ hiđrocacbon:
a) Oxi hoá metan: CH4 + O2 HCHO + H2O
b) Oxi hoá hoàn toàn etilen: 2CH2 = CH2 + O2 2CH3CHO
c) Từ C2H2 : CH º CH + H2O CH3CHO
I. Định nghĩa, phân loại, danh pháp
1. Định nghĩa: Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (COOH) liên kết trực tiếp với nguyên tử C hoặc nguyên tử hiđro.
- Dãy đồng đẳng axit no, đơn chức, mạch hở là : CnH2n + 1COOH (với n ³ 0) hoặc CmH2m O2 (với m ³ 1).
2. Danh pháp
a) Tên thay thế:
Ví dụ: CH3COOH : axit etanoic HCOOH : axit metanoic.
CH3 – CH(CH3) – CH2 – CH2 – COOH : axit 4 – metyl pentanoic
b) Tên thông thường: tên theo nguồn gôc tìm ra.
II. Tính chất vật lí
- Các axit đều là chất lỏng hoặc rắn.
- Nhiệt độ sôi của các axit tăng theo chiều tăng của phân tử khối và cao hơn nhiệt độ sôi của các ancol cùng khối lượng.
Nguyên nhân: Do liên kết hiđro trong các phân tử axit bền hơn trong các phân tử ancol (liên kết hidro liên phân tử và nội phân tử).
III. Tính chất hoá học:
1. Tính axit:
a) Axit cacboxylic phân li thuận nghịch trong dung dịch: RCOOH RCOO - + H+
b) Tác dụng với bazơ; oxit bazơ:
c) Tác dụng với muối:
d) Tác dụng với kim loại trước hiđro trong dãy hoạt động hoá học của các kim loại:
2 . Phản ứng thế nhóm – OH:
Etyl axetat
+ Phản ứng giữa ancol với axit tạo thành este và H2O gọi là phản ứng este hoá.
+ Phản ứng este hoá là phản ứng thuận nghịch và H2SO4 đặc làm xúc tác.
IV. Điều chế: (CH3COOH)
1. Phương pháp lên mem giấm: C2H5OH + O2 CH3COOH + H2O
2 . Oxi hoá anđehit axetic: CH3CHO + O2 2CH3COOH
3. Oxi hoá ankan – butan: 2CH3CH2CH2CH3 + O2 4CH3COOH + 2H2O
4. Từ metanol: CH3OH + CO CH3COOH (Đây là phương pháp sản xuất CH3COOH hiện đại.
XEM THÊM:
YOPOVN xin gửi đến quý thầy cô, các em học sinh Kiến thức hóa lớp 11 học kì 2 TỔNG HỢP TÓM TẮT hệ thông kiến thức hóa lớp 11 học kì 2 RẤT CHI TIẾT. Đây là bộ Kiến thức hóa lớp 11 học kì 2, kiến thức hóa lớp 11 học kì 2, tổng hợp kiến thức hóa 11 học kì 2, hệ thông kiến thức hóa lớp 11 học kì 2....
Tìm kiếm có liên quan
Tổng hợp kiến thức Hóa 11 học kì 2
Tổng hợp kiến thức Hóa 11 học kì 1
Tổng hợp kiến thức Hóa 11 PDF
Tổng hợp kiến thức hóa 11 nâng cao
Chương trình hóa 11 học kì 2
Sơ đồ tư duy Hóa 11 học kì 2
File công thức Hóa 11
Tài liệu ôn tập Hóa 11 học kì 2
Tổng hợp kiến thức Hóa 11 học kì 2
Tổng hợp kiến thức Hóa 11 học kì 1
Sơ đồ tư duy Hóa 11 học kì 2
Tổng hợp kiến thức hóa 11 nâng cao
Tổng hợp kiến thức Hóa 11 PDF
Chương trình hóa 11 học kì 2
Tài liệu ôn tập Hóa 11 học kì 2
File công thức Hóa 11
Tổng hợp kiến thức Hóa 11 học kì 2
Tổng hợp kiến thức Hóa 11 học kì 1
Sơ đồ tư duy Hóa 11 học kì 2
Tổng hợp kiến thức hóa 11 nâng cao
Tổng hợp kiến thức Hóa 11 PDF
Chương trình hóa 11 học kì 2
Tài liệu ôn tập Hóa 11 học kì 2
File công thức Hóa 11
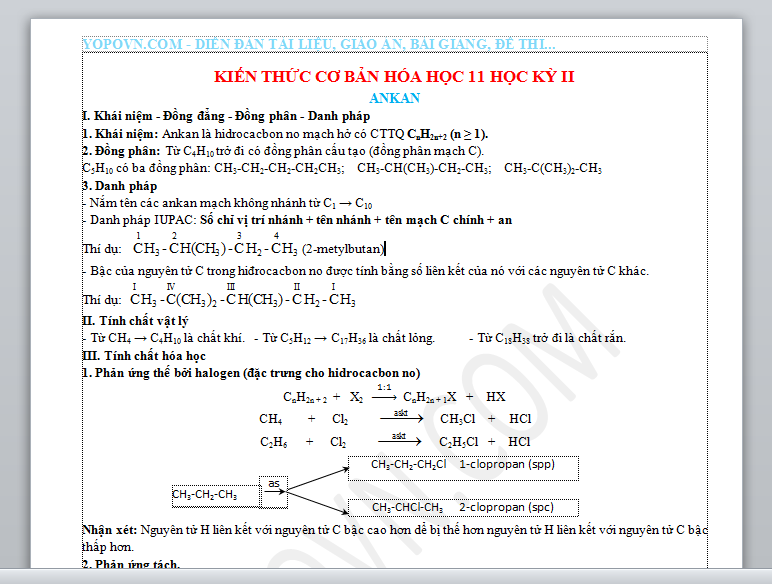
KIẾN THỨC CƠ BẢN HÓA HỌC 11 HỌC KỲ II
ANKAN
ANKAN
I. Khái niệm - Đồng đẳng - Đồng phân - Danh pháp
1. Khái niệm: Ankan là hidrocacbon no mạch hở có CTTQ CnH2n+2 (n ≥ 1).
2. Đồng phân: Từ C4H10 trở đi có đồng phân cấu tạo (đồng phân mạch C).
C5H10 có ba đồng phân: CH3-CH2-CH2-CH2CH3; CH3-CH(CH3)-CH2-CH3; CH3-C(CH3)2-CH3
3. Danh pháp
- Nắm tên các ankan mạch không nhánh từ C1 → C10
- Danh pháp IUPAC: Số chỉ vị trí nhánh + tên nhánh + tên mạch C chính + an
Thí dụ: (2-metylbutan)
- Bậc của nguyên tử C trong hiđrocacbon no được tính bằng số liên kết của nó với các nguyên tử C khác.
Thí dụ:
II. Tính chất vật lý
- Từ CH4 → C4H10 là chất khí. - Từ C5H12 → C17H36 là chất lỏng. - Từ C18H38 trở đi là chất rắn.
III. Tính chất hóa học
1. Phản ứng thế bởi halogen (đặc trưng cho hidrocacbon no)
CnH2n + 2 + X2 CnH2n + 1X + HX
CH4 + Cl2 CH3Cl + HCl
C2H6 + Cl2 C2H5Cl + HCl
CH4 + Cl2 CH3Cl + HCl
C2H6 + Cl2 C2H5Cl + HCl
Nhận xét: Nguyên tử H liên kết với nguyên tử C bậc cao hơn dể bị thế hơn nguyên tử H liên kết với nguyên tử C bậc thấp hơn.
2. Phản ứng tách.
- Tách H:
- Crackinh:
3. Phản ứng oxi hóa.
CnH2n+2 + O2 → nCO2 + (n +1)H2O
Nhận xét: > nankan = nH2O - nCO2
IV. Điều chế
a. Phòng thí nghiệm:
- RCOONa + NaOH R-H + Na2CO3
Thí dụ: CH3COONa + NaOH CH4↑ + Na2CO3
- Al4C3 + 12H2O → 3CH4↑ + 4Al(OH)3
b. Trong công nghiệp: Đi từ khí thiên nhiên, khí mỏ dầu và từ dầu mỏ.
---------------{--------------
ANKEN
ANKEN
I. Khái niệm - Đồng phân - Danh pháp
1. Khái niệm:
- Anken là hidrocacbon không no mạch hở có một nối đôi trong phân tử.
- CTTQ là CnH2n (n)
2. Đồng phân: Có hai loại đồng phân
- Đồng phân cấu tạo: (Đồng phân mạch C và đồng phân vị trí liên kết đôi)
Thí dụ: C4H8 (3 đp cấu tạo) CH2=CH-CH2-CH3; CH3-CH=CH-CH3; CH2=C(CH3)-CH3
- Đồng phân hình học (cis - trans):
Thí dụ: CH3-CH=CH-CH3 có hai đồng phân hình học
cis but-2-en trans but-2-en3. Danh pháp:
- Danh pháp thường: Tên ankan nhưng thay đuôi an = ilen.
Thí dụ: C2H4 (etilen), C3H6 (propilen)
- Danh pháp IUPAC:
Số chỉ vị trí nhánh + tên nhánh + tên mạch C chính + số chỉ vị trí liên kết đôi + en
(C4H8) But-2-en (C4H8) 2 - Metylprop-1-en
II. Tính chất vật lý
Ở điều kiện thường thì : - Từ C2H4 → C4H8 là chất khí. - Từ C5H10 trở đi là chất lỏng hoặc chất rắn.
III. Tính chất hóa học
1. Phản ứng cộng (đặc trưng)
* Cộng H2: CnH2n + H2 CnH2n+2
CH2=CH-CH3 + H2 CH3-CH2-CH3
* Cộng Halogen: CnH2n + X2 CnH2nX2
CH2=CH2 + Br2 CH2Br-CH2Br
Phản ứng anken tác dụng với Br2 dùng để nhận biết anken (dung dịch Br2 mất màu)
* Cộng HX (X: Cl, Br, OH . . .)
Thí dụ: CH2=CH2 + HOH CH3-CH2OH
CH2=CH2 + HBr CH3-CH2Br
- Các anken có cấu tạo phân tử không đối xứng khi cộng HX có thể cho hỗn hợp hai sản phẩm
- Quy tắc Maccopnhicop: Trong phản ứng cộng HX vào liên kết đôi, nguyên tử H (phần mang điện dương) chủ yếu cộng vào nguyên tử C bậc thấp hơn (có nhiều H hơn), còn nguyên hay nhóm nguyên tử X (phần mang điện âm) cộng vào nguyên tử C bậc cao hơn (ít H hơn).
2. Phản ứng trùng hợp:
3. Phản ứng oxi hóa:
- Oxi hóa hoàn toàn: CnH2n + 3n/2O2 nCO2 + nH2O (=)
- Oxi hóa không hoàn toàn: Anken có thể làm mất màu dung dịch thuốc tím.
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2(OH)-CH2(OH) + 2MnO2 + 2KOH
4. Điều chế
a. Phòng thí nghiệm: CnH2n+1OH CnH2n + H2O
b. Điều chế từ ankan: CnH2n+2 CnH2n + H2
---------------{--------------
ANKADIEN
I. Định nghĩa - Phân loại - Danh pháp
1. Định nghĩa: Là hidrocacbon không no mạch hở, trong phân tử chứa hai liên kết C=C, có CTTQ CnH2n-2
- Ví dụ: CH2=C=CH2, CH2=CH-CH=CH2 . . .
2. Phân loại: Có ba loại:
- Ankadien có hai liên kết đôi liên tiếp.
- Ankadien có hai liên kết đôi cách nhau bởi một liên kết đơn (ankadien liên hợp).
- Ankadien có hai liên kết đôi cách nhau từ hai liên kết đơn trở lên.
3. Danh pháp:
Số chỉ vị trí nhánh + tên nhánh + tên anka mạch C chính + số chỉ vị trí liên kết đôi + đien.
CH2=CH-CH=CH2 (buta-1,3-đien) CH2=C(CH3)-CH=CH2 (2-metyl buta-1,3-đien) - Isopren
II. Tính chất hóa học
1. Phản ứng cộng (H2, X2, HX)
* Cộng H2: CH2=CH-CH=CH2 + 2H2 CH3-CH2-CH2-CH3
* Cộng brom, HX:
Cộng 1:2 CH2=CH-CH=CH2 + Br2 (dd) CH2=CH-CHBr-CH2Br (spc)
Cộng 1:4 CH2=CH-CH=CH2 + Br2 (dd) CH2Br-CH=CH-CH2Br (spc)
Cộng đồng thời vào hai liên kết đôi
CH2=CH-CH=CH2 + 2Br2 (dd) CH2Br-CHBr-CHBr-CH2Br
* Cộng HX
Cộng 1:2 CH2=CH-CH=CH2 + HBr CH2=CH-CHBr-CH3 (spc)
Cộng 1:4 CH2=CH-CH=CH2 + HBr CH2=CH-CH2-CH2Br (spc)
2. Phản ứng trùng hợp:
- VD:
Cao su buna
3. Phản ứng oxi hóa:
- Oxi hóa hoàn toàn: 2C4H6 + 11O2 8CO2 + 6H2O
- Oxi hóa không hoàn toàn: Tương tự như anken thì ankadien có thể làm mất màu dung dịch thuốc tím. Phản ứng này dùng để nhận biết ankadien.
III. Điều chế
- Được điều chế từ ankan tương ứng bằng phản ứng tách H2.
CH3CH2CH2CH3 CH2=CH-CH=CH2 + 2H2
CH3-CH(CH3)-CH2-CH3 CH2=C(CH3)-CH=CH2 + 2H2
2C2H5OH CH2=CH-CH=CH2 + 2H2 + H2O
---------------{--------------
ANKIN
I. Khái niệm - Đồng phân - Danh pháp
1. Khái niệm: Là hidrocacbon không no mạch hở trong phân tử có một liên kết ba .
CTTQ là CnH2n-2 (n2).
2. Đồng phân
- Chỉ có đồng phân cấu tạo (đồng phân mạch C và đồng phân vị trí liên kết ).
Thí dụ: C4H6 có hai đồng phân CH≡C-CH2-CH3; CH3-C≡C-CH3.
3. Danh pháp:
- Danh pháp thường: Tên gốc ankyl + axetilen
Thí dụ: C2H2 (axetilen), CH≡C-CH3 (metylaxetilen)
- Danh pháp IUPAC:
Số chỉ vị trí nhánh + tên nhánh + tên mạch C chính + số chỉ vị trí nối 3 + in
But-1-in But-2-in
II. Tính chất hóa học
1. Phản ứng cộng (H2, X2, HX, phản ứng đime hóa và trime hóa).
+ Cộng H2
CnH2n - 2 + 2H2 CnH2n + 2
CH≡CH + 2H2 CH3-CH3
Nếu dùng xúc tác Pd/PbCO3 hoặc Pd/BaSO4, ankin chỉ cộng một phân tử H2 tạo anken
CnH2n - 2 + H2 CnH2n
CH≡CH + H2 CH2=CH2
+ Cộng X2 (Ankin làm mất màu dung dịch Brom tương tự anken, ankadien)
CH≡C-CH3 + 2Br2 CHBr2-CBr2-CH3
+ Cộng HX (Tuân theo quy tắc Mac-côp-nhi-cốp)
CH3-C≡CH CH3-CCl=CH2 CH3-CCl2-CH3
CH≡CH + HCl CH2 =CHCl
CH≡CH + H2O CH3CHO
+ Phản ứng đime hóa - trime hóa
2CH≡CH CH2=CH-C≡CH (vinyl axetilen)
3CH≡CH C6H6 (benzen)
2. Phản ứng thế bằng ion kim loại
*Điều kiện: Phải có liên kết 3 ở đầu mạch.
R-C≡CH + AgNO3 + NH3 → R-C≡CAg↓ + NH4NO3
CH3-C≡CH + AgNO3 + NH3 → CH3-C≡CAg (↓ màu vàng) + NH4NO3
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg (↓ màu vàng) + 2NH4NO3
* Phản ứng này dùng để nhận biết Ank-1-in
3. Phản ứng oxi hóa:
- Oxi hóa hoàn toàn: CnH2n-2 + (3n-1)/2 O2 → nCO2 + (n-1)H2O ()
- Oxi hóa không hoàn toàn: Tương tự như anken và ankadien, ankin cũng có khả năng làm mất màu dung dịch thuốc tím. Phản ứng này dùng để nhận biết ankin.
III. Điều chế:
a. Phòng thí nghiệm: CaC2 + 2H2O → C2H2↑ + Ca(OH)2
b. Trong công nghiệp: 2CH4 C2H2 + 3H2
---------------{--------------
BENZEN VÀ DÃY ĐỒNG ĐẴNG
I. Đồng đẳng - Đồng phân - Danh pháp
1. Đồng đẳng: Dãy đồng đẵng của benzen có CTTQ là CnH2n-6 (n ≥ 6)
2. Đồng phân:
- Đồng phân về vị trí tương đối của các nhóm ankyl xung quanh vòng benzen (o, m, p).
- Đồng phân mạch C
3. Danh pháp: Gọi tên theo danh pháp hệ thống.
Số chỉ vị trí nhóm ankyl + tên ankyl + benzen
Ví dụ: C6H5CH3 metylbenzen (toluen) C6H5C2H5 etylbenzen
II. Tính chât hóa học:
1. Phản ứng thế:
* Thế nguyên tử H ở vòng benzen
- Tác dụng với halogen: C6H6 + Br2 C6H5Br + HBr
Cho ankyl benzen phản ứng với brom có xúc tác bột Fe thì thu được hỗn hợp sản phẩm thế brom chủ yếu vào vị trí ortho và para.
o-bromtoluen
p-bromtoluen
- Phản ứng giữa benzen và đồng đẳng với axit HNO3 xãy ra tương tự như phản ứng với halogen.
- Quy tắc thế H ở vòng benzen: Các ankyl benzen dể tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen và sự thế ưu tiên ở vị trí ortho và para so với nhóm ankyl.
* Thế nguyên tử H ở gốc ankyl
C6H5CH3 + Br2 C6H5CH2Br + HBr
2. Phản ứng cộng (H2 và Cl2)
3. Phản ứng oxi hóa:- Oxi hóa không hoàn toàn: Ankyl benzen có khả năng làm mất màu dung dịch thuốc tím đun nóng.
- Phản ứng oxi hóa hoàn toàn:
CnH2n-6 + (3n-3)/2O2 → nCO2 + (n-3)H2O
III. STIREN:
1. Cấu tạo: CTPT: C8H8; CTCT:
2. Tính chất hóa học:
a. Tính chất của anken
- Stiren làm mất màu dung dịch Br2 (Dùng để nhận biết stiren): C6H5CH=CH2 + Br2 → C6H5CHBr-CH2Br
- Phản ứng với H2
- Tham gia phản ứng trùng hợp ở liên kết đôi C=C.
b. Tính chất của benzen (Phản ứng thế nguyên tử H ở vòng benzen)c. Phản ứng oxi hóa
Stiren phản ứng dung dịch KMnO4 ở điều kiện thường (oxi hóa liên kết đôi C=C); đun nóng (oxi hóa nhóm –CH=CH2).
---------------{--------------
ANCOL
I. Định nghĩa
- Ancol là những hợp chất hữu cơ trong phân tử có nhóm OH liên kết trực tiếp với nguyên tử C no.
- Bậc ancol là bậc của nguyên tử C liên kết trực tiếp với nhóm OH.
Thí dụ
CH3-CH2-CH2-CH2OH: ancol bậc I CH3-CH2-CH(CH3)-OH: ancol bậc II
CH3-C(CH3)2-OH:ancol bậc III
II. Đồng phân - Danh pháp
1. Đồng phân: Chỉ có đồng phân cấu tạo (gồm đồng phân mạch C và đồng phân vị trí nhóm OH).
- Thí dụ: C4H10O có 4 đồng phân ancol
CH3-CH2-CH2-CH2OH CH3-CH(CH3)-CH2OH CH3-CH2-CH(CH3)-OH CH3-C(CH3)2-OH
2. Danh pháp:
- Danh pháp thường: Ancol + tên gốc ankyl + ic
+ Ví dụ: C2H5OH (ancol etylic)
- Danh pháp thay thế: Tên hidrocacbon tương ứng với mạch chính + số chỉ vị trí nhóm OH + ol
+ Ví dụ: (3-metylbutan-1-ol)
III. Tính chất vật lý
- Tan nhiều trong nước do tạo được liên kết H với nước. Độ tan trong nước giảm dần khi số nguyên tử C tăng lên .
- Nhiệt đô sôi cao hơn so với hidrocacbon cùng CTPT hoặc đồng phần ete (do liên kết hidro giữa các phân tử ancol)
IV. Tính chất hóa học
1. Phản ứng thế H của nhóm OH
* Tính chất chung của ancol
2C2H5OH + 2Na → 2C2H5ONa + H2↑
2ROH + 2Na → 2RONa + H2↑
* Tính chất đặc trưng của ancol đa chức có hai nhóm OH liền kề
- Hòa tan được Cu(OH)2 ở điều kiện thường tạo thành dung dịch màu xanh lam. Phản ứng này dùng để nhận biết ancol đa chức có hai nhóm OH liền kề.
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O
2. Phản ứng thế nhóm OH
* Phản ứng với axit vô cơ C2H5 - OH + H - Br C2H5Br + H2O
* Phản ứng với ancol
2C2H5OH C2H5OC2H5 (đietyl ete) + H2O
- TQ: 2ROH R-O-R + H2O
3. Phản ứng tách nước
C2H5OH C2H4 + H2O
- TQ: CnH2n+1OH CnH2n + H2O
4. Phản ứng oxi hóa:
- Oxi hóa không hoàn toàn:
+ Ancol bậc 1 khi bị oxi hóa bởi CuO/to cho ra sản phẩm là andehit
RCH2OH + CuO RCHO + Cu↓ + H2O
+ Ancol bậc hai khi bị oxi hóa bởi CuO/to cho ra sản phẩm là xeton.
R-CH(OH)-R’ + CuO R-CO-R’ + Cu↓ + H2O
+ Ancol bậc III khó bị oxi hóa.
- Oxi hóa hoàn toàn: CnH2n+1OH + 3n/2O2 nCO2 + (n+1)H2O
V. Điều chế:
a. Phương pháp tổng hợp:
Điều chế từ anken tương ứng: CnH2n + H2O CnH2n+1OH
b. Phương pháp sinh hóa: Điều chế C2H5OH từ tinh bột.
(C6H10O5)n C6H12O6 C6H12O6 2C2H5OH + 2CO2
---------------{--------------
PHENOL
1. Định nghĩa: Phenol là những hợp chất hữu cơ trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử C vòng benzen.
- Ví dụ: C6H5OH (phenol) . . .
2. Tính chất vật lý
- Đk thường là chất rắn; ít tan trong nước lạnh, tan nhiều trong nước nóng.
- Rất độc, dây vào tay gây bỏng nặng.
3. Tính chất hóa học
a. Phản ứng thế nguyên tử H của nhóm OH
- Tác dụng với kim loại kiềm
2C6H5OH + 2Na → 2C6H5ONa + H2↑
- Tác dụng với dung dịch bazơ
C6H5OH + NaOH → C6H5ONa + H2O
b. Phản ứng thế H của vòng benzen
- Tác dụng với dung dịch Brom
C6H5OH + 3Br2 → C6H2Br3OH (↓ màu trắng) + 3HBr
- Tác dụng với dung dịch HNO3
C6H5OH + 3HNO3 → C6H2(NO3)3OH (↓ màu vàng) + 3H2O
Chú ý: Hai phản ứng trên dùng để nhận biết phenol.
---------------{--------------
ANDEHIT
I. Định nghĩa, phân loại, danh pháp:
1. Định nghĩa: Anđehit là những HCHC trong phân tử có nhóm CHO (nhóm cacbonyl) liên kết trực tiếp với nguyên tử cacbon (1) hoặc nguyên tử hiđro.
2. Phân loại:
- Có nhiều cách phân loại: (sgk)
- Anđehit no, đơn chức, mạch hở có công thức chung là : CnH2n + 1CHO (với n ³ 0) hoặc CnH2n O (với n ³ 1).
3. Danh pháp:
a) Tên thông thường: Tên gọi = anđehit + tên axit tương ứng.
Ví dụ: H – CHO : anđehit fomic CH3 – CHO: anđehit axetic. C6H5 – CHO: anđehit benzoic
b) Tên thay thế: Tên gọi = tên hiđrocacbon tương ứng mạch chính + al
Ví dụ: HCHO : metanal CH3CHO : etanal CH3CH2CHO : propanal
II. Tính chất hoá học:
1. Tính oxi hóa
* Phản ứng cộng với hiđro:
CH3CHO + H2 CH3 CH2 OH
Tổng quát: R-CHO + H2 R – CH2OH
+ Trong phản ứng trên R–CHO đóng vai trò chất oxi hoá.
2. Tính khử
a) Phản ứng với dung dịch AgNO3/NH3 (Phản ứng tráng bạc)
R–CHO + 2AgNO3 + H2O +3NH3 2NH4NO3 + 2Ag¯ + RCOONH4
CH3CHO + 2AgNO3 + H2O +3NH3 2NH4NO3 + 2Ag¯ + CH3COONH4
*HCHO + 4AgNO3 + 2H2O +6NH3 4NH4NO3 + 4Ag¯ + (NH4)2CO3
* Chú ý: Phản ứng tác dụng với dung dịch AgNO3 /NH3 dùng để nhận biết anđehit.
b) Phản ứng với oxi: 2RCHO + O2 2RCOOH
2CH3CHO + O2 2CH3COOH
c) Phản ứng với dung dịch nước Br2
2RCHO + H2O + Br2 2RCOOH + HBr
* Andehit làm mất màu dung dịch Brom và dung dịch KMnO4
III. Điều chế:
1. Từ ancol: Oxi hoá ancol bậc I ® anđehit R – CH2OH + CuO R – CHO + H2O + Cu
2 . Từ hiđrocacbon:
a) Oxi hoá metan: CH4 + O2 HCHO + H2O
b) Oxi hoá hoàn toàn etilen: 2CH2 = CH2 + O2 2CH3CHO
c) Từ C2H2 : CH º CH + H2O CH3CHO
--------------------------{--------------------------
AXIT CACBOXYLIC
I. Định nghĩa, phân loại, danh pháp
1. Định nghĩa: Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (COOH) liên kết trực tiếp với nguyên tử C hoặc nguyên tử hiđro.
- Dãy đồng đẳng axit no, đơn chức, mạch hở là : CnH2n + 1COOH (với n ³ 0) hoặc CmH2m O2 (với m ³ 1).
2. Danh pháp
a) Tên thay thế:
Tên gọi = axit + tên hiđrocacbon no tương ứng với mạch chính + oic
Ví dụ: CH3COOH : axit etanoic HCOOH : axit metanoic.
CH3 – CH(CH3) – CH2 – CH2 – COOH : axit 4 – metyl pentanoic
b) Tên thông thường: tên theo nguồn gôc tìm ra.
Cấu tạo | Tên gọi | Cấu tạo | Tên gọi |
HCOOH (M=46) | Axit fomic | CH3COOH (M=60) | Axit axetic |
CH3CH2COOH (M=74) | Axit propionic | CH3CH2CH2COOH | Axit butiric |
CH2=CHCOOH (M=72) | Axit acrylic | CH2=C(CH3)COOH (M=86) | Axit metacrylic |
(COOH)2 | Axit oxalic | C6H5COOH | Axit benzoic |
II. Tính chất vật lí
- Các axit đều là chất lỏng hoặc rắn.
- Nhiệt độ sôi của các axit tăng theo chiều tăng của phân tử khối và cao hơn nhiệt độ sôi của các ancol cùng khối lượng.
Nguyên nhân: Do liên kết hiđro trong các phân tử axit bền hơn trong các phân tử ancol (liên kết hidro liên phân tử và nội phân tử).
III. Tính chất hoá học:
1. Tính axit:
a) Axit cacboxylic phân li thuận nghịch trong dung dịch: RCOOH RCOO - + H+
b) Tác dụng với bazơ; oxit bazơ:
CH3COOH + NaOH ® CH3 COONa + H2O
2CH3COOH + ZnO ® (CH3COO)2Zn + H2O
c) Tác dụng với muối:
CaCO3 + 2CH3COOH ® (CH3 COO)2Ca + CO2 + H2O
d) Tác dụng với kim loại trước hiđro trong dãy hoạt động hoá học của các kim loại:
2CH3COOH + Zn ® (CH3 COO)2Zn + H2
2 . Phản ứng thế nhóm – OH:
RCOOH + R’OH RCOOR’ + H2O
CH3COOH + HO-C2H5 CH3COOC2H5 + H2O
Etyl axetat
+ Phản ứng giữa ancol với axit tạo thành este và H2O gọi là phản ứng este hoá.
+ Phản ứng este hoá là phản ứng thuận nghịch và H2SO4 đặc làm xúc tác.
IV. Điều chế: (CH3COOH)
1. Phương pháp lên mem giấm: C2H5OH + O2 CH3COOH + H2O
2 . Oxi hoá anđehit axetic: CH3CHO + O2 2CH3COOH
3. Oxi hoá ankan – butan: 2CH3CH2CH2CH3 + O2 4CH3COOH + 2H2O
4. Từ metanol: CH3OH + CO CH3COOH (Đây là phương pháp sản xuất CH3COOH hiện đại.
XEM THÊM:
- Kế hoạch giáo dục môn hóa 11 MỚI NHẤT
- Giáo án hóa 11 nâng cao cả năm
- Đề thi học kì 2 hóa 11 có đáp án
- Chuyên đề hóa 11 có đáp án Học Kì 2
- Bài tập trắc nghiệm và tự luận Hidrocacbon
- Bài tập Hiđrocacbon không no hóa 11 có đáp án
- Bài tập trắc nghiệm về Hiđrocacbon
- Bài tập chuyên đề về hiđrocacbon không no
- Câu trắc nghiệm hidro không no
- Giải bài tập hóa học lớp 11
- Đề Thi HSG Hóa 11
- Sách Hóa học vô cơ tập 3
- Sách hóa học vô cơ 11 tập 1
- Bài tập hóa học 11 sự điện li nâng cao
- Đề Thi Olympic Môn Hóa 11
- Đề Thi HSG Môn Hóa 11 Cấp Trường
- Lý thuyết về ancol và phenol
- Đề kiểm tra học kì 1 môn hóa 11
- Đề Cương Ôn Tập Hóa 11 Học Kì 1
- Trắc nghiệm hóa học 11
- Đề thi giữa kì 2 hóa 11 trắc nghiệm
- Đề thi hsg cấp trường môn hóa lớp 11
- Đề thi học kì 1 hóa 11 trắc nghiệm
- Tài liệu hóa 11 nâng cao: Chương 9 hóa học 11
- Trắc nghiệm hóa 11 chương 8
- Đề kiểm tra giữa kì 2 hóa 11 trắc nghiệm có đáp án
- Đề kiểm tra hóa 11 học kì 2 trắc nghiệm
- Đề thi thử trắc nghiệm hóa 11 học kì 2



